Hipertensión ocular, ¿cuándo tratar? Pauta de diagnóstico y seguimiento
Laura Morales
1. OBJETIVOS
- Objetivo principal: Diseño de un protocolo de manejo, tratamiento y seguimiento en la patología de la hipertensión ocular. Para ello, se realizará una revisión sistemática de la literatura publicada hasta la fecha, sintetizando y unificando ésta, para su aplicación a la práctica clínica diaria.
- Objetivo secundario: Establecer unas pautas de diagnóstico de hipertensión ocular. Unificar la definición de hipertensión ocular (nos llevará a fijar unas pautas de diagnóstico claras y concisas que permitan incluir a todos los pacientes afectos. Asimismo, otro de los objetivos de este protocolo, es conseguir estandarizar parámetros fiables, que garanticen un seguimiento certero de los pacientes con hipertensión ocular, evitando una progresión inadvertida.
- Objetivo terciario: mejorar la calidad de vida del paciente. Evitando consultas innecesarias por exceso y diagnósticos tardíos por defecto.
2. DEFINICIÓN
Según las Guías Europeas de Glaucoma (1), se define hipertensión ocular, como aquella entidad de etiología y fisiopatología desconocida, que se caracteriza por los siguiente signos y síntomas: Presión intraocular (PIO) > 21 mmHg sin tratamiento; campo visual normal; papila y capa de fibras nerviosas retinianas normales; gonioscopia que demuestre un ángulo abierto excluyendo cierres angulares intermitentes y ausencia de antecedentes o signos de otra enfermedad ocular o uso de corticoides.
3. DIAGNÓSTICO
a) Diagnóstico clínico
El primer paso, a la hora de hacer un diagnóstico de hipertensión ocular, consiste en realizar una anamnesis dirigida a obtener información acerca de antecedentes familiares de glaucoma y/o hipertensión ocular, uso de esteroides, episodios previos de uveítis, cirugías refractivas previas, traumatismos o alteraciones cardiovasculares. La presencia de alguno de estos factores puede condicionar el futuro tratamiento de la hipertensión ocular.
El aumento de la PIO ha sido reconocido como el principal factor de riesgo, para el desarrollo de glaucoma de ángulo abierto y su progresión (2) (3) y es también el único factor de riesgo que puede ser controlado y modificado, tanto con tratamiento médico como quirúrgico. Por esto es de vital importancia obtener una medida fiable de la PIO(4) .
El gold standard adoptado para este fin es el la tonometría de aplanación, que se suele realizar con el tonómetro de Goldmann (GAT) (5) (6). La medida de la presión intraocular habrá de realizarse antes de la gonioscopia y dilatación pupilar, y su registro deberá acompañarse de la hora del día, además del valor de tensión arterial. El ritmo circadiano de la presión intraocular puede ser evaluado mediante una curva de tensión diurna, que demuestre las posibles fluctuaciones. Del mismo modo puede realizarse una monitorización ambulatoria de la presión arterial (MAPA) durante 24 horas, para descartar la presencia de una hipotensión subclínica que pueda poner en riesgo el flujo sanguíneo ocular (7) (8) (9) (10) (11).
Se debe prestar especial atención a errores que pueden surgir a las medidas con GAT(12) . Entre las causas de estos errores se incluyen maniobras de valsalva durante la medición, respiración entrecortada, apretar los párpados, todos estos pueden elevar de manera ficticia la medida de la PIO. Es bien conocida la importancia de la medida del espesor corneal central (ECC), cuyo valor normal en la población española es de 544,3±33 µm en mujeres y de 543,1±29 µm en hombres (13) . De este modo, valores altos de ECC, pueden causar una sobrestimación del valor de la PIO y valores bajos de ECC una infraestimación de la misma. Si bien, todavía no existe un acuerdo en cuanto a si existe un algoritmo de corrección útil y validado para correlacionar las medidas de GAT y ECC y en general no deben emplearse para corregir los valores.
Para completar el diagnóstico clínico, se evaluará tanto la cabeza del nervio óptico como la capa de fibras nerviosas mediante lámpara de hendidura, bajo dilatación pupilar. Se prestará especial atención a:
- Tamaño de la papila.
- Muestra variaciones, dependiendo del grupo racial, siendo mayor en individuos de raza negra. Discos ópticos grandes, pudieran ser más susceptibles al daño glaucomatoso. El diámetro vertical normal en población blanca es de 1.3-1.7 mm. (14).
- Relación excavación/ papila. (E/P).
- Diferencias de 0.2 mm entre ambos ojos son sospechosas, pero no siempre implican daño glaucomatoso.
- Anillo neurorretiniano:
- En el 83% de los ojos sanos se cumple que el espesor de anillo neurorretiniano ínfero-temporal > superotemporal > nasal > temporal. Si esto se altera, violación de la regla ISNT, se debe descartar un daño secundario en el nervio óptico (NO) (14).
b) Pruebas diagnósticas
El diagnóstico de hipertensión ocular, exige la presencia de al menos dos campos visuales con ausencia de daño. La perimetría estática, es una prueba subjetiva que depende de la colaboración del paciente por lo tanto resulta fundamental contar con dos pruebas realizadas de forma fiable.
Tanto la perimetría estática automatizada Humphrey como Octopus, son válidas para detectar defectos glaucomatosos en el campo visual. ASi por ejemplo, en un estudio de referencia como el OHTS (The Ocular Hypertension Treatment Study) (3), la perimetría empleada fue Humphrey y sin embargo en el estudio EGPS (The European Glaucoma Prevention Study) (2), se utilizaron indistintamente ambas.
Sin embargo, resulta fundamental para detectar daño glaucomatoso, utilizar un programa que explore al menos los 24o centrales. Resulta aconsejable debido a la agilidad que se requiere para la asistencia clínica actual, utilizar programas de corta duración, ejemplo de esto sería Octopus estrategia TOP.
Los primeros defectos en el campo visual aparecen con mayor frecuencia en la zona superior, como consecuencia del daño en la cabeza del NO en la zona de mayor vulnerabilidad (el cuadrante inferior) (15).
La tomografía de coherencia óptica (OCT) permite cuantificar, con una resolución cercana a las 4 µm. (16) , el grosor de capa de fibras nerviosas de la retina (CFNR).Son ya varios los grupos de trabajo que desde su introducción en los 90, han estudiado el comportamiento del espesor de CFNR, en pacientes con HTO. La mayor parte de estos encuentran diferencias significativas cuando se comparan pacientes normales con aquellos diagnosticados de hipertensión ocular (17). En concreto, se encontró una reducción significativa de la CFNR en los cuatro cuadrantes del nervio óptico. Siendo esta reducción mayor en los cuadrantes inferiores (15). Sin embargo, en el trabajo de Iester et all. (18), no evidenciaron diferencias en los parámetros medidos con Heildeber Retinal Tomograph (HRT), entre pacientes con HTO y normales.
Además recientemente, el grupo de trabajo español, liderado por Larrosa JM., ha diseñado una calculadora de diagnóstico basada en los datos de la OCT cirrus(19). La calculadora considera 8 parámetros, que son aquellos que han demostrado una mayor capacidad diagnóstica de glaucoma. Entre estos se incluyen variables cualitativas (atribuye el valor 0 al color verde, 1 al amarillo y 2 al rojo considerando los sectores del análisis de células ganglionares nasal superior y temporal superior, grosor mínimo en el análisis de células ganglionares y relación E/P) y cuantitativas (el valor de CFNR inferior, el valor de células ganglionares inferior temporal, la relación E/P vertical y la edad del paciente).
Esta calculadora de diagnóstico ofrece la probabilidad de presentar glaucoma en tanto por ciento y riesgo cualitativo (bajo, intermedio y alto). Siendo una herramienta complementaria de muy útil valor en todos los casos de hipertensión ocular, en los cuales no siempre es fácil delimitar la línea que separa la HTO del glaucoma (19).
Una herramienta similar fue presentada por el grupo de trabajo para el tratamiento de la hipertensión ocular que analizando los grupos del estudio OHTS, desarrolló un modelo de predicción validado que predice la probabilidad de que un paciente con HTO, se convierta a GPAA, valorando la edad, la PIO media, media del grosor corneal central, media de la excavación vertical, media del PSD (pattern estándar deviation) dB. (20) [Anexo 2]
c) Criterios para el diagnóstico de hipertensión ocular
La literatura coincide que el diagnóstico de HTO, debe cumplir los siguientes criterios (21):
- PIO sin tratamiento > 21 mmHg.
- Gonioscopía: ángulo abierto.
- Campo visual: Ausencia de daño.
- Ausencia de causa secundaria de elevación de PIO ( como uveítis, trauma, pseudoexfoliación o síndrome de dispersión pigmentaria)
4. TRATAMIENTO
Según estudios epidemiológicos un 10% de los pacientes diagnosticados de hipertensión ocular acabarán desarrollando glaucoma (22), por tanto, es de vital importancia detectar a tiempo a estos pacientes para iniciar un tratamiento, que evite la progresión. A la hora de plantearse el tratamiento, la única diana accesible para el oftalmólogo es la reducción de la PIO. Para este fin, existen alternativas tanto médicas como quirúrgicas.
A día de hoy, no existe una evidencia clara entre la reducción de la PIO y la conversión a GPAA (2). El estudio OHTS mostró que es posible retrasar el desarrollo de GPAA, en pacientes HTO, alcanzando una reducción de la PIO de un 18% y manteniendo al menos 5 años. Sin embargo el posterior estudio EGPS, el cual comparaba el efecto de la dorzolamida frente a placebo, no pudo confirmar los hallazgos anteriores.
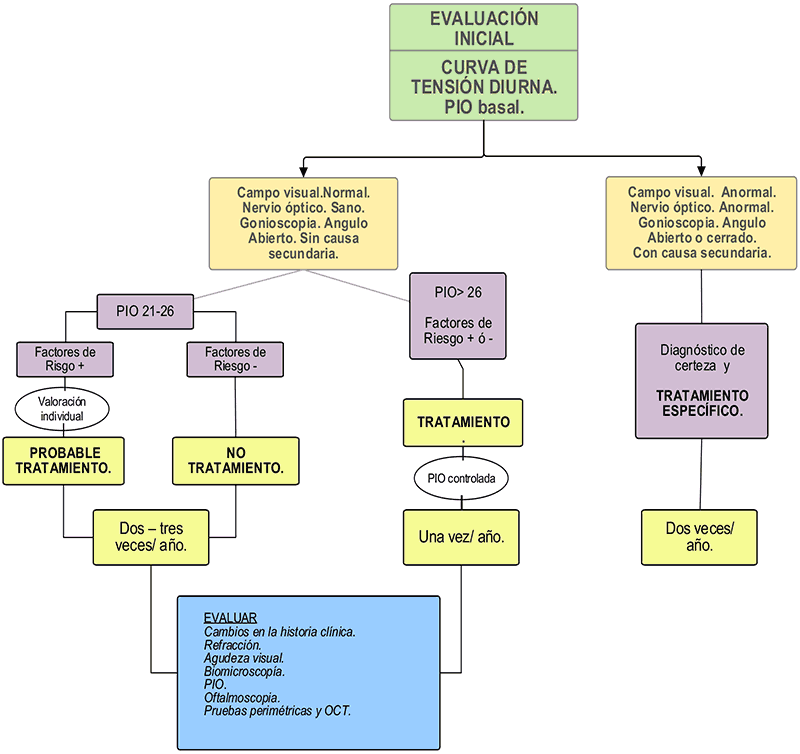
Actualmente el árbol de decisión a la hora de iniciar tratamiento gira alrededor de la PIO. Por ello inicialmente es fundamental determinar la PIO basal (y en algunos casos se puede considerar la realización de una curva tensional diurna) así como determinar el valor de la paquimetría corneal.
Ante un paciente con PIO elevada pero con campos visuales, nervio óptico, gonioscopia sanos y sin causa secundaria para la elevación de la misma, el modelo de actuación dependerá del valor de la PIO y de las características del paciente. Como criterio general puede ser razonable:
- Si PIO > 26 mmHg: Se recomienda iniciar tratamiento y seguimiento.
- Si PIO 21-25 mmHg: Se recomienda vigilancia periódica cada 3/4 meses.
Además del valor de la PIO, es fundamental descartar la presencia de factores de riesgo para la progresión y desarrollo de glaucoma como: la edad (>40 años), raza, historia familiar de glaucoma, presencia de diabetes mellitus, miopía y también factores sociales, como la dificultad de seguimiento periódico. Igualmente es fundamental considerar las opiniones del paciente así como los efectos secundarios asociados el tratamiento en cada paciente.
- Si existen factores de riesgo positivos, incluso con PIO > 21mmHg se podría plantearía el comienzo de tratamiento y seguimiento del paciente.
A la hora de comenzar tratamiento en la mayoría de los casos, el primer escalón terapéutico es el tratamiento médico en monoterapia. Sin embargo, de acuerdo con las características del paciente se puede considerar el tratamiento con láser (trabeculoplastía). En cualquier caso el objetivo del tratamiento es alcanzar un rango de presión que disminuya la probabilidad de conversión a glaucoma. Dicho rango de presión se calculara para cada paciente de manera individual, teniendo en cuanta además los posibles efectos secundarios, costes del tratamiento, su complejidad y la repercusión en la calidad de vida del paciente.
Actualmente los análogos de prostaglandina son considerados como fármaco de elección (primera línea terapéutica), sin embargo el β-Bloqueante (timolol 0,5%) ha sido utilizado durante años como primera opción (21). Se sugiere iniciar el tratamiento con análogos de prostaglandinas y en caso de contraindicación se recomienda el uso de β-Bloqueante. Cuando no se logre obtener la PIO diana, se recomienda emplear combinaciones de ambos o con inhibidores de anhidrasa carbónica tópica y alfa agonistas.
5. SEGUIMIENTO
El seguimiento de los pacientes con HTO es fundamental tanto si se ha comenzado un tratamiento como si no. Durante el seguimiento se recomienda una exploración completa para la detección precoz de progresión que puedan dar lugar al desarrollo de glaucoma.
Se sugiere que el paciente con hipertensión ocular en tratamiento sea evaluado una vez al año una vez conseguido el objetivo terapéutico, comparando los resultados de la exploración de forma longitudinal en el tiempo. Para aquellos pacientes con hipertensión ocular sin tratamiento (y por tanto sin factores de riesgo y con PIO < 26) la re-evaluación debe realizarse cada 6-12 meses de acuerdo con el rango de presión y el riesgo(22).
En cada visita se evaluarán:
- Cambios en la historia clínica.
- Refracción.
- Agudeza visual.
- Biomicroscopía.
- PIO (cada +1mmHg incrementa un 16% el riesgo de desarrollo de glaucoma y 31% de desarrollar lesiones en el campo visual).
- Oftalmoscopia.
- Pruebas complementarias (perimétricas y OCT).
ANEXO I. Diagrama de flujo diagnóstico y seguimiento.
ANEXO II. Ocular Hypertension Treatment Study Group, European Glaucoa Preventio Study Group (3).
- Validated Prediction Model for the development of primary open-angle Glaucoma in indiiduals with ocular hypertension. Ophtalology 2007;114:10-19.
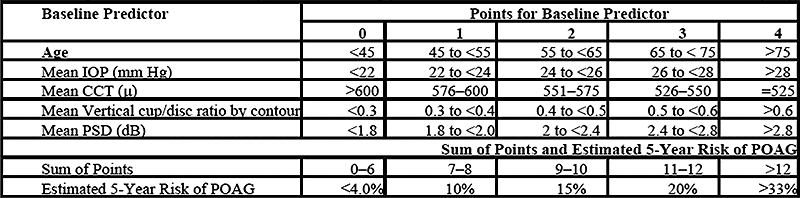
- CCT: central corneal thickness. dB Decibel. IOP: Intraocular pressure. POAG: Priamary open angle glaucoma. PSD: Pattern standard deviation.
Bibliografía
- European Glaucoma Society Terminology and Guidelines for Glaucoma, 4th Edition - Part 1<br/>Supported by the EGS Foundation. British Journal of Ophthalmology. 2017;101:1-72.
- Miglior S, Zeyen T, Pfeiffer N, Cunha-Vaz J, Torri V, Adamsons I, et al. Results of the European Glaucoma Prevention Study. Ophthalmology. 2005;112(3):366-75.
- Kass MA, Heuer DK, Higginbotham EJ, Johnson CA, Keltner JL, Miller JP, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-13; discussion 829-30.
- Leske MC, Connell AM, Wu SY, Hyman LG, Schachat AP. Risk factors for open-angle glaucoma. The Barbados Eye Study. Arch Ophthalmol. 1995;113(7):918-24.
- Barleon L, Hoffmann EM, Berres M, Pfeiffer N, Grus FH. Comparison of dynamic contour tonometry and goldmann applanation tonometry in glaucoma patients and healthy subjects. Am J Ophthalmol. 2006;142(4):583-90.
- Dielemans I, Vingerling JR, Hofman A, Grobbee DE, de Jong PT. Reliability of intraocular pressure measurement with the Goldmann applanation tonometer in epidemiological studies. Graefe’s archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 1994;232(3):141-4.
- Klein BE, Klein R, Knudtson MD. Intraocular pressure and systemic blood pressure: longitudinal perspective: the Beaver Dam Eye Study. Br J Ophthalmol. 2005;89(3):284-7.
- Jurgens C, Grossjohann R, Tost FH. Relationship of systemic blood pressure with ocular perfusion pressure and intraocular pressure of glaucoma patients in telemedical home monitoring. Medical science monitor : international medical journal of experimental and clinical research. 2012;18(11):Mt85-9.
- Wang YX, Xu L, Zhang XH, You QS, Zhao L, Jonas JB. Five-year change in intraocular pressure associated with changes in arterial blood pressure and body mass index. The beijing eye study. PloS one. 2013;8(10):e77180.
- Huang J, Katalinic P, Kalloniatis M, Hennessy MP, Zangerl B. Diurnal Intraocular Pressure Fluctuations with Self-tonometry in Glaucoma Patients and Suspects: A Clinical Trial. Optometry and vision science : official publication of the American Academy of Optometry. 2018;95(2):88-95.
- He Z, Nguyen CT, Armitage JA, Vingrys AJ, Bui BV. Blood pressure modifies retinal susceptibility to intraocular pressure elevation. PloS one. 2012;7(2):e31104.
- Bengtsson B, Heijl A. A long-term prospective study of risk factors for glaucomatous visual field loss in patients with ocular hypertension. Journal of glaucoma. 2005;14(2):135-8.
- Sánchez-Tocino H, Bringas-Calvo R, Iglesias-Cortiñas D. Correlación entre presión intraocular, paquimetría y queratometría en una población normal %J Archivos de la Sociedad Española de Oftalmología. 2007;82:267-72.
- Bowling B. KANSKI. OFTALMOLOGIA CLINICA un enfoque sistematico;un enfoque sistematico. AMSTERDAM: ELSEVIER; 2016.
- Choi MG, Han M, Kim YI, Lee JH. Comparison of glaucomatous parameters in normal, ocular hypertensive and glaucomatous eyes using optical coherence tomography 3000. Korean journal of ophthalmology : KJO. 2005;19(1):40-6.
- Puzyeyeva O, Lam WC, Flanagan JG, Brent MH, Devenyi RG, Mandelcorn MS, et al. High-resolution optical coherence tomography retinal imaging: a case series illustrating potential and limitations. Journal of ophthalmology. 2011;2011:764183.
- Gyatsho J, Kaushik S, Gupta A, Pandav SS, Ram J. Retinal nerve fiber layer thickness in normal, ocular hypertensive, and glaucomatous Indian eyes: an optical coherence tomography study. Journal of glaucoma. 2008;17(2):122-7.
- Iester M, Broadway DC, Mikelberg FS, Drance SM. A comparison of healthy, ocular hypertensive, and glaucomatous optic disc topographic parameters. Journal of glaucoma. 1997;6(6):363-70.
- Larrosa JM, Moreno-Montanes J, Martinez-de-la-Casa JM, Polo V, Velazquez-Villoria A, Berrozpe C, et al. A Diagnostic Calculator for Detecting Glaucoma on the Basis of Retinal Nerve Fiber Layer, Optic Disc, and Retinal Ganglion Cell Analysis by Optical Coherence Tomography. Investigative ophthalmology & visual science. 2015;56(11):6788-95.
- Gordon MO, Torri V, Miglior S, Beiser JA, Floriani I, Miller JP, et al. Validated prediction model for the development of primary open-angle glaucoma in individuals with ocular hypertension. Ophthalmology. 2007;114(1):10-9.
- Peeters A, Webers CA, Prins MH, Hendrikse F, Schouten JS. The clinical impact of 2 different strategies for initiating therapy in patients with ocular hypertension. Journal of glaucoma. 2011;20(1):30-6.
- Diagnóstico y Tratamiento de Hipertensión Ocular México. . In: Salud Sd, editor. 2013.