Innovación y nuevas tecnologías aplicadas al diagnóstico y tratamiento médico del glaucoma
José Luis Urcelay Segura, Blanca Monsalve Córdova, Enrique Normand de la Sotilla, Pablo J. Mazagatos Used, Rubén Yela Delgado, José Diogo da Saude Lourenço
Sección de Glaucoma. Servicio de Oftalmología. Hospital General Universitario Gregorio Marañón
Introducción
La incesante innovación tecnológica plantea a los oftalmólogos el reto de mantener actualizados sus conocimientos respecto a una diversidad de instrumental y aparataje que con frecuencia no está disponible en todos los centros.
En estos últimos años, se ha despertado un enorme y justificado interés por el desarrollo y aplicación de nuevos procedimientos quirúrgicos de glaucoma, que bajo el epígrafe de cirugía de glaucoma mínimamente invasiva (MIGS) han abierto interesantes vías de avance en el tratamiento quirúrgico. Sin embargo, otras líneas muestran también evoluciones que merecen ser valoradas.
Para ello, en este artículo se revisan, de forma concisa, las principales novedades aplicables al diagnóstico y tratamiento médico del glaucoma, valorando en qué medida pueden aportar valor a nuestra práctica clínica presente y futura. Nuestro objetivo no es hacer una descripción exhaustiva de cada una de ellas sino mostrar una breve actualización del estado actual de este campo en constante desarrollo.
En lo referente al diagnóstico del glaucoma, analizaremos la tomografía de coherencia óptica (OCT) swept source, la angiografía por OCT, la OCT de segmento anterior y los tonómetros ORA (Ocular Response Analyzer) y Corvis-ST. Respecto a las innovaciones al tratamiento médico del glaucoma, nos centraremos en los distintos sistemas de liberación mantenida de fármacos y comentaremos brevemente otras líneas de investigación.
Tomografía de Coherencia Óptica SWEPT SOURCE (SS-OCT)
Desde su aparición en 1991 (1) y su aplicación al campo de la oftalmología hace aproximadamente 15 años, la OCT ha experimentado sucesivos avances en protocolos de imagen, algoritmos de análisis, y nuevos parámetros que han maximizado su potencial para al diagnóstico, evaluación de la respuesta al tratamiento, y detección de la progresión de varias enfermedades oculares incluyendo el glaucoma (2). Los sistemas iniciales estaban basados en la interferometría realizada en el dominio tiempo (TD-OCT), posteriormente superada por la basada en el dominio espectral (SD-OCT), y más recientemente por la swept source (SS-OCT), cuya traducción literal al español sería fuente de barrido (3).
La SS-OCT utiliza una longitud de onda superior (1050 nm frente a 840 nm en la SD-OCT) en el láser que emite la señal, para intentar minimizar la dispersión de la luz que crean tanto el epitelio pigmentario como los vasos sanguíneos. También dispone de fotorreceptores en lugar de cámaras CCD, lo que conduce a una alta resolución (1 μm frente a las 10 micras de la TD-OCT), alta velocidad y mejora de la calidad de las imágenes captadas. En principio, la penetración de la SS-OCT sería similar a la de la SD-OCT si en ésta activamos la opción enhanced depth imaging (EDI) (4).
De cara al diagnóstico del glaucoma, existen varios sistemas disponibles que nos permiten obtener un análisis detallado de la excavación y la cabeza del nervio óptico, la capa de fibras nerviosas de la retina alrededor del nervio óptico y de la capa de células ganglionares alrededor de la mácula (figuras 1 Y 2). Sin embargo, el diagnóstico precoz del glaucoma sigue siendo un desafío por la sensibilidad de los test en el glaucoma preperimétrico y la lenta evolución de la enfermedad. Los programas informáticos para el análisis de progresión del glaucoma utilizados de forma aislada no son suficiente para la toma de decisiones (5).
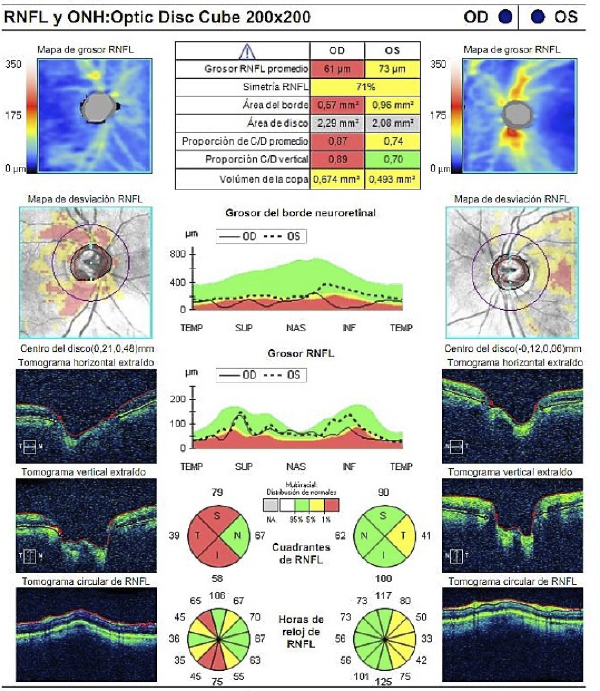
Figura 1. Análisis con OCT de la cabeza del nervio óptico y de la capa de fibras nerviosas de la retina en un paciente con glaucoma, más avanzado en OD que en OI.
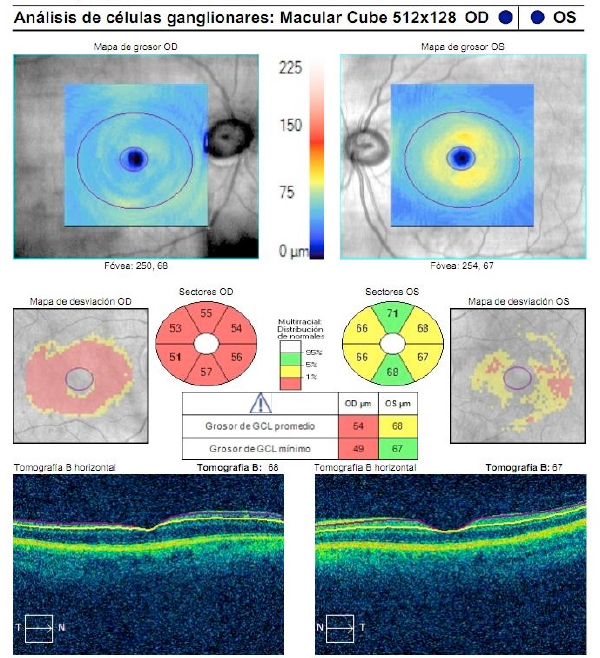
Figura 2. Análisis con OCT de la capa de células ganglionares en un paciente con glaucoma, más avanzado en OD que en OI. Es el mismo paciente de la figura 1.
Aunque con la SD-OCT esto era ya posible, el análisis tridimensional de los datos de la OCT ha tenido un desarrollo más reciente. Aplicando este análisis a la cabeza del nervio óptico se ha propuesto los conceptos de distancia mínima de la banda (MDB, en sus siglas en inglés), que se define como la distancia más corta entre la membrana limitante interna y la membrana de Bruch (o la terminación del epitelio pigmentario de la retina, que en la OCT todavía resulta indistinguible de la membrana de Bruch), la apertura mínima del anillo de la membrana de Bruch (BMO-MRW) y el volumen del anillo. Estos tres parámetros tridimensionales del anillo neurorretiniano tendrían una mayor capacidad diagnóstica comparados con los parámetros bidimensionales del anillo neurorretiniano (área y grosor) y la misma o mejor capacidad diagnóstica que el grosor de la capa de fibras nerviosas de la retina (RNFL) (6). El análisis del BMO-MRW podría ser especialmente útil en papilas oblicuas y con miopía moderada (7,8).
Otra posible aplicación de la SS-OCT, pendiente aún de sistematizar con métodos automáticos de cuantificación (9), estaría en el análisis de la lámina cribosa. De acuerdo con la teoría biomecánica, en la etiopatogenia del glaucoma el aumento de la presión intraocular (PIO) produciría una deformación de la lámina cribosa que dificultaría el flujo axonal y la irrigación sanguínea, lo que conduciría a una apoptosis de las células ganglionares que se reflejaría posteriormente en la cabeza del nervio óptico. Desde una perspectiva biomecánica, la lámina cribosa es un punto débil dentro del recubrimiento corneoescleral del globo ocular. Varios estudios han estudiado la profundidad, inserción, curvatura, grosor y aparición de defectos focales en la lámina cribosa en pacientes con glaucoma. Sin embargo, los tejidos prelaminares y la vascularización siguen dificultando una evaluación completa de la lámina cribosa en algunos casos, especialmente en la detección de su borde posterior. El grosor de la coroides peripapilar puede influir en la medida de la profundidad de la lámina cribosa, de forma que en ojos con una coroides peripapilar gruesa se sobreestimaría la profundidad y ésta se infraestimaría con una coroides fina (10). Se necesitan aún más estudios para dilucidar los mejores parámetros de la biomecánica laminar, sus cambios morfológicos, de flujo sanguíneo y de actividad celular y su relación con la patogénesis y progresión del glaucoma (11,12).
ANGIO-OCT (OCT-A)
La angiografía por OCT permite estudiar de forma simultánea, rápida y no invasiva la vascularización de la retina y la coroides, analizar la densidad y el flujo vascular, generando imágenes por capas y tridimensionales (figura 3). La adquisición simultánea de información estructural y vascular permite establecer una correlación entre ellas (2).
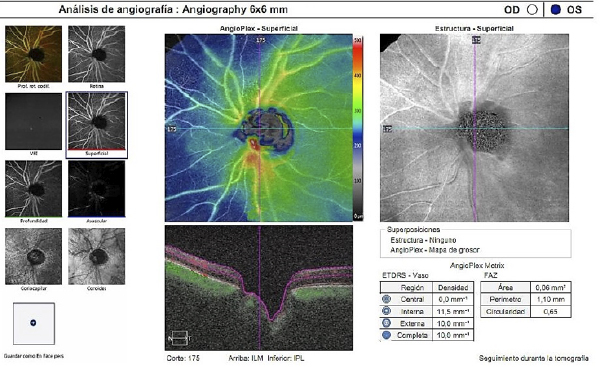
Figura 3. Angio-OCT en un paciente con glaucoma.
La OCT-A se basa en la detección del movimiento de los hematíes dentro de los vasos mediante un análisis computerizado de sucesivos B-scans repetidos rápidamente. Aunque la OCT-A no es algo exclusivo de la SS-OCT, sino que se podría realizar con un sistema SD-OCT de al menos 70.000 A-scans por segundo (3), la SS-OCT permite una mejor visualización de la coroides (13) y detección del límite posterior de la esclera (14). La OCT-A no proporciona información sobre el flujo absoluto en microlitros/minuto sino que establece un índice de flujo en unidades arbitrarias y no en todos los instrumentos comerciales disponibles. La proyección de los vasos superficiales puede generar artefactos que limiten la capacidad de medir independiente el flujo superficial y profundo de la cabeza del nervio óptico (15).
De acuerdo con la teoría vascular, la irrigación sanguínea de la cabeza del nervio óptico jugaría un papel principal en la etiopatogenia del glaucoma. La arteria ciliar posterior es responsable del mayor aporte a la cabeza del nervio óptico y ramas de la coroides peripapilar nutren la región prelaminar.
En comparación con controles sanos, y a igualdad de edad, se ha detectado en pacientes con glaucoma una reducción del flujo sanguíneo en diversas estructuras: en la cabeza del nervio óptico (disminución de la densidad microvascular papilar así como pérdida de la microvasculatura peripapilar profunda en las zonas de atrofia peripapilar), en la retina (aumento de la zona avascular foveal perdiendo su forma circular normal), en la coroides (adelgazamiento de la coroides peripapilar) y finalmente, en la circulación retrobulbar (2, 15, 16) (figura 4).
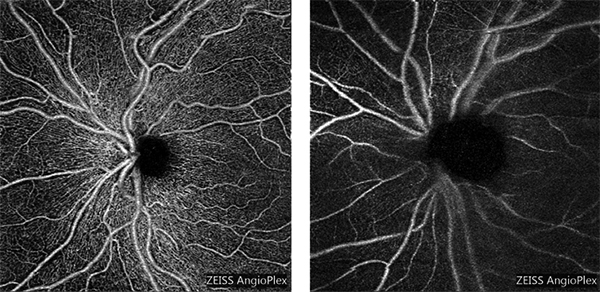
Figura 4. Detalle de la angiografía superficial con OCT de los capilares retinianos peripapilares en un paciente sano (derecha) y un paciente con glaucoma (izquierda), en el que se aprecia una menor densidad vascular.
Aunque no existen aún estudios longitudinales que permitan aclarar si estas alteraciones de la vascularización son causa o efecto del glaucoma, el grado de reducción parece correlacionarse con la severidad del glaucoma. La reducción del índice de flujo vascular en los pacientes con glaucoma oscila entre el 25 y 35% respecto a pacientes sanos.
En el desarrollo de la OCT-A queda pendiente elaborar bases de datos de normalidad con individuos sanos, confirmar la reproducibilidad de estos valores tanto en sanos como en diferentes estadios y tipos de glaucoma, comparar la capacidad discriminativa de la OCT-A con los mejores parámetros de la OCT peripapilar y macular, y definir la correlación entre OCT-A y el campo visual (15). La precisión de la OCT-A para el diagnóstico del glaucoma puede variar en función de si el cálculo de la densidad vascular se realiza en el plexo superficial, profundo o en el espesor retiniano completo. Hasta el momento la OCT-A no ha demostrado mayor capacidad diagnóstica que el análisis de la capa de fibras nerviosas de la retina.
OCT DE SEGMENTO ANTERIOR (OCT-SA)
La tomografía de coherencia óptica del segmento anterior (OCT-SA) es una técnica diagnóstica que nos permite obtener imágenes de alta resolución de una manera rápida, segura y no invasiva.
Mediante la OCT-SA es posible estudiar la anatomía de prácticamente la totalidad de estructuras que conforman el polo anterior: película lagrimal, córnea, conjuntiva, esclera, músculos extraoculares, cámara anterior, ángulo iridocorneal, iris y cristalino (17).
En el campo del glaucoma, la OCT-SA puede ser de utilidad principalmente en dos aspectos: como herramienta diagnóstica y en el postoperatorio de una cirugía de glaucoma.
A nivel diagnóstico, nos permite realizar una valoración cuantitativa del volumen de la cámara anterior y del riesgo de cierre angular. Los nuevos dispositivos de OCT-SA nos ofrecen imágenes angulares de una resolución comparable a técnicas histológicas, pero de una manera inocua, eliminando el componente subjetivo de la exploración y aumentando su reproducibilidad (18-22).
Con la OCT-SA es posible cuantificar la apertura angular, valorar su evolución a lo largo del tiempo e indicar en un momento dado la conveniencia de realizar una iridotomía láser. Posteriormente, nos permitirá estudiar los factores que influyen en la eficacia de la iridotomía, así como comprobar su permeabilidad, tamaño, abertura angular y aumento del volumen total de la cámara anterior (23) (figura 5).
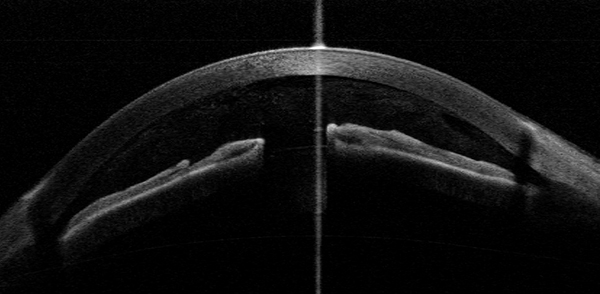
Figura 5. OCT-SA tras una iridotomía. Además del orificio de la iridotomía, se observa la dispersión de pigmento en la cámara anterior. Cortesía del Dr. Javier Haritz Urcola.
Para ello han surgido nuevas mediciones angulares, entre las que caben destacar la abertura angular (TIA), la distancia de abertura angular (AOD500), parámetro cardinal en el diagnóstico de cierre angular, la AOD750, útil en el estudio de la configuración del iris así como el área irido-trabecular (TISA500) correspondiente al área de filtrado efectivo de la malla trabecular (17).
También ha aumentado el interés en estructuras como la malla trabecular y el canal de Schlemm, no sólo por su relevancia en la fisiopatología del humor acuoso, sino por el estudio de los cambios que se producen tras una cirugía de filtración clásica y, de modo evidente, debido a su relación con la emergente cirugía del glaucoma mínimamente invasiva.
La OCT-SA permite monitorizar el proceso de cicatrización tras la cirugía filtrante. Según el estudio de los hallazgos conjuntivales, esclerales y supracoroideos sería posible establecer un pronóstico post-quirúrgico (24-27). Además, la OCT-SA puede ser útil en la indicación de diversas maniobras postoperatorias como el needling, masaje, suturolisis, goniopunción o la desincarceración láser del iris. Esta técnica posibilita también el estudio longitudinal y transversal de diversos tratamientos destinados a modular la cicatrización como los antimitóticos, espaciadores y biomembranas.
Nuevos tonómetros: OCULAR RESPONSE ANALYZER Y CORVIS-ST
El aumento de la presión intraocular (PIO) es el principal factor de riesgo modificable para el desarrollo y progresión del glaucoma. El método más empleado hoy en día para su determinación es la tonometría de aplanación de Goldmann (TAG), la cual se basa en el principio físico de Imbert-Fick, según el cual la PIO es proporcional a la presión aplicada sobre la córnea y al espesor corneal central (ECC).
Sin embargo, fue el propio Goldmann quien reconoció que las asunciones físicas empleadas en el diseño del TAG estaban basadas en modelos oculares con un ECC constante, por lo que la tonometría en córneas de elevado grosor o muy finas podría dar lugar, respectivamente, a una importante sobrestimación o infraestimación de las medidas reales (28).
La influencia del ECC junto con otros factores ha llevado al desarrollo de nuevos tonómetros menos influenciables por el ECC y por las propiedades biomecánicas de la córnea, como son el Ocular Response Analyzer (ORA) y el Corvis-ST (CST).
El ORA actúa como un tonómetro de no contacto, registrando y analizando las propiedades biomecánicas de la córnea cuando ésta es sometida a un impulso de aire de corta duración. En un primer tiempo, el aire a presión provoca un movimiento de la córnea hacia adentro, un aplanamiento posterior y finalmente una ligera concavidad. Milisegundos más tarde se detiene el impulso de aire y la córnea recupera su configuración inicial, pasando por una segunda etapa de aplanamiento.
Los valores de presión del aplanamiento inward y outward no coinciden, según el principio de Imbert-Fick; su diferencia sería la medición de la histéresis corneal (HC). Una media de estas dos determinaciones se correspondería con la presión del TAG (PIOg) y su procesamiento daría lugar a la presión intraocular corneal compensada (PIOcc), la cual representa un valor de PIO libre de la influencia de la resistencia corneal durante la aplanación (29-31).
Sin embargo, en el estudio de 2006 de Martínez de la Casa J.M. (32) y en el de Vandewelle (33) en 2009, se evidencia una sobreestimación de la PIO por parte del ORA con respecto al TAG.
Por su parte, el CST es un tonómetro de no contacto que aporta un valor de PIO ya corregido en función de parámetros de biomecánica corneal. Incorpora una cámara Scheimpflug que permite disponer de imágenes de la cámara anterior así como valorar la deformabilidad corneal y su respuesta al impulso de aire en tiempo real (28).
Los parámetros de biomecánica corneal que proporciona son la velocidad, el tiempo, la longitud de la primera y segunda aplanación, la concavidad máxima, la amplitud de la deformación y el radio de curvatura corneal.
En cuanto a su correlación con las medidas obtenidas con el TAG, Hong et al (34) describen en su estudio valores de PIO con CST similares a los proporcionados por TAG; sin embargo, observaron una tendencia a la infraestimación de las mediciones. Bañeros no encontró tampoco diferencias significativas entre TAG y CST (28). Además, ambos estudios señalan que no fue posible conseguir una total independencia de los valores de PIO con CST respecto a las propiedades biomecánicas corneales.
Dispositivos de liberación prolongada de fármacos en el tratamiento del glaucoma crónico
Entre las limitaciones de la efectividad del tratamiento médico del glaucoma crónico destacan la variación de concentraciones terapéuticas de fármaco a lo largo del día y el cumplimiento terapéutico subóptimo por parte de los pacientes.
Para intentar mejorar el control de la enfermedad y evitar la progresión aparecen los dispositivos de liberación prolongada de fármacos, que facilitarían la aplicación de los principios activos, mejorando el cumplimiento y estabilizando los niveles terapéuticos del fármaco mediante una liberación continuada.
Tipos de dispositivos de liberación prolongada de fármacos
Anillos de fórnix
Se trata de una estructura anular de 24 a 29 mm de diámetro realizada a base de un polímero no bioabsorbible que libera concentraciones terapéuticas de bimatoprost sin conservantes durante 6 meses y que se implanta bajo anestesia tópica en el fórnix conjuntival (superior e inferior).
En un ensayo clínico randomizado (35) se mostraron reducciones de la presión intraocular (PIO) de entre 4 y 6 mmHg, con un perfil de efectos secundarios similar al de la aplicación clásica de bimatoprost en colirio.
La frecuencia de extrusión del dispositivo, principal inconveniente del mismo, fue del 10% en los primeros 6 meses, siendo la pérdida del anillo advertida por el paciente en todos los casos.
Dispositivos intracamerales
Están en desarrollo dispositivos biodegradables intracamerales como Artemis (Bimatoprost SR, Allergan®), que en ensayos clínicos fase 1/2 consiguieron reducciones de la PIO de 7 a 9 mmHg tras 4-6 meses de seguimiento (36). En la actualidad están en desarrollo ensayos clínicos en fase 3. Los principales inconvenientes de estos dispositivos serían los vinculados a cualquier procedimiento intraocular, tanto complicaciones infecciosas como relacionadas con el proceso de implantación del dispositivo.
Tapones de punto lacrimal
Existen tapones de punto lacrimal inferior con capacidad para liberar latanoprost y travoprost sin conservantes, entre otros posibles principios activos. Se han conseguido niveles terapéuticos durante hasta 3 meses con este tipo de dispositivos. El riesgo de pérdida de fármaco hacia la fosa nasal y de dislocación inadvertida del dispositivo que provocaría un periodo de falta de tratamiento activo son inconvenientes que han determinado que el desarrollo de estos dispositivos no haya sido tan dinámico como el de otras opciones terapéuticas.
Lentes de contacto
Se han desarrollado lentes de contacto, tanto corneales como de apoyo escleral, impregnadas con diversos principios activos y que permitirían una liberación continua y prolongada del fármaco. En algunos estudios se han conseguido concentraciones terapéuticas durante 1 mes (37) con lentes impregnadas con latanoprost.
Otros dispositivos
También en desarrollo, aunque con un futuro más incierto, están otros dispositivos, como los implantes subconjuntivales o los geles de efecto retardado.
En la actualidad nos encontramos en la búsqueda del dispositivo ideal, que sería uno de fácil implantación, con eficacia demostrada, barato y con un perfil de seguridad con pocos efectos adversos y complicaciones asociadas a su implantación. Hasta el momento que se desarrolle un dispositivo de tales características, el futuro de los presentes en la práctica clínica actual pasa por coexistir con el tratamiento tópico con colirios clásico.
Otras líneas de investigación en el tratamiento médico del glaucoma
Inhibidores de las Rho quinasas (ripasudil, netarsudil)
SI bien el tratamiento farmacológico escapa al objeto de esta revisión, incluimos este pequeño apartado por los recientes avances acaecidos en relación a estos principios activos y que pueden significar su próxima disponibilidad. Representan un nuevo grupo farmacológico que podría ser útil en el tratamiento del glaucoma. Su mecanismo de acción consiste en aumentar el drenaje del humor acuoso a través de la malla trabecular, reduciendo la presión venosa epiescleral, y disminuyendo la producción de humor acuoso. El ripasudil ha sido aprobado para su uso en Japón cuando otros tratamientos no resultan efectivos o no pueden ser administrados (38). El netarsudil (39) al 0,02% ha obtenido en octubre de 2017 el voto favorable del comité asesor de la FDA (Food and Drug Administration) por lo que, aunque este voto no lo implica necesariamente, podría ser aprobado para su uso en Estados Unidos el próximo año.
Nanocápsulas o nanoesferas
El desarrollo de formulaciones que prolonguen la duración del efecto farmacológico supondría un gran beneficio de cara a facilitar el cumplimiento terapéutico por parte del paciente y la efectividad de las mismas. Permiten además reducir la cantidad de conservantes empleados y aumentar la especificidad celular (40-42).
Vectores asociados a adenovirus para terapia génica
Aunque también se ha ensayado el uso de adenovirus, virus herpes simplex, y lentivirus, los vectores asociados a adenovirus son los más ampliamente utilizados en terapia génica dirigida a la malla trabecular (43). Se pretende conseguir la mayor expresión génica posible con la menor reacción inflamatoria posible.
La factibilidad de la expresión de metaloproteinasas inducida por vectores asociados a adenovirus ha sido investigada en estudios recientes. Se ha observado que las metaloproteinasas remodelan la matriz extracelular de la malla trabecular, lo que reduce la resistencia al paso del humor acuoso y disminuye la PIO en modelos animales (44).
Bibliografía
- Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W et al. Optical coherence tomography. Science 1991; 254: 1178-1181.
- Mwanza JC, Budenz DL. New developments in optical coherence tomography imaging for glaucoma. Curr Opin Ophthalmol. 2017 Nov 14 [Epub ahead of print].
- R. Abreu-González, R. Gallego-Pinazo, R. Dolz-Marco, J. Donate López, L. López Guajardo. Swept Source OCT versus Spectral Domain OCT: mitos y realidades. Arch Soc Esp Oftalmol 2016;91:459-60.
- Waldstein SM, Faatz H, Szimacsek M, Glodan AM, Podkowinski D, Montuoro A, et al. Comparison of penetration depth in choroidal imaging using swept source vs spectral domain optical coherence tomography. Eye (Lond). 2015;29:409–15.
- Moreno-Montañés J, Antón V, Antón A, Larrosa JM, Martinez-de-la-Casa JM, Rebolleda G, Ussa F, García-Granero M. Intraobserver and Interobserver Agreement of Structural and Functional Software Programs for Measuring Glaucoma Progression. JAMA Ophthalmol. 2017 Apr 1;135(4):313-319.
- Fan KC, Tsikata E, Khoueir Z, Simavli H, Guo R, de Luna RA, Pandit S, Que CJ, de Boer JF, Chen TC. Enhanced Diagnostic Capability for Glaucoma of 3-Dimensional Versus 2-Dimensional Neuroretinal Rim Parameters Using Spectral Domain Optical Coherence Tomography. J Glaucoma. 2017 May;26(5):450-458.
- Rebolleda G, Casado A, Oblanca N, Muñoz-Negrete FJ. The new Bruch's membrane opening - minimum rim width classification improves optical coherence tomography specificity in tilted discs. Clin Ophthalmol. 2016 Dec 5;10:2417-2425. eCollection 2016.
- Sastre-Ibañez M, Martinez-de-la-Casa JM, Rebolleda G, Cifuentes-Canorea P, Nieves-Moreno M, Morales-Fernandez L, Saenz-Frances F, Garcia-Feijoo J. Utility of Bruch membrane opening-based optic nerve head parameters in myopic subjects. Eur J Ophthalmol. 2017 Aug 11. [Epub ahead of print].
- Wang B, Nevins JE, Nadler Z, et al. In vivo lamina cribrosa microarchitecture in healthy and glaucomatous eyes as assessed by optical coherence tomography. Invest Ophthalmol Vis Sci. 2013;54:82708274.
- Rebolleda G, Díez-Álvarez L, de Juan V, Muñoz-Negrete FJ. Biomechanical Responses of Lamina Cribrosa to Intraocular Pressure Change Assessed by Optical Coherence Tomography in Glaucoma Eyes. Invest Ophthalmol Vis Sci. 2017 Jul 1;58(9):3376. Letter to the Editor.
- Yong Woo Kim, Jin Wook Jeoung, Young Kook Kim, Ki Ho Park. Clinical Implications of In Vivo Lamina Cribrosa Imaging in Glaucoma. J Glaucoma. 2017 Sep;26(9):753-761.
- Downs JC, Girkin CA. Lamina cribrosa in glaucoma. Curr Opin Ophthalmol 2017; 28:113–119.
- Adhi M, Liu JJ, Qavi AH, Grulkowski I, Lu CD, Mohler KJ, Ferrara D, Kraus MF, Baumal CR, Witkin AJ, Waheed NK, Hornegger J, Fujimoto JG, Duker JS: Choroidal analysis in healthy eyes using swept-source optical coherence tomography compared to spectral domain optical coherence tomography. Am J Ophthalmol 2014; 157: 1272–1281.
- Park HY, Shin HY, Park CK. Imaging the posterior segment of the eye using swept-source optical coherence tomography in myopic glaucoma eyes: comparison with enhanced depth imaging. Am J Ophthalmol 2014; 157: 550–557.
- Adán A (coordinador), Zarranz-Ventura J (coordinador), Pazos M, Biarnés M, González Ventosa A. Angiografía por tomografía de coherencia óptica. 49ª Monografía de la Sociedad Española de Oftalmología. Capítulo 30, p. 187-192. 2017.
- Pablo LE, Cameo B, Bambo MP, Polo V, Larrosa JM, Fuertes MI, Güerri N, Ferrandez B, Garcia-Martin E. Peripapillary Choroidal Thickness Analysis Using Swept-Source Optical Coherence Tomography in Glaucoma Patients: A Broader Approach. Ophthalmic Res. 2017 Sep 23. [Epub ahead of print]
- Urcola Carrera J. A, Vila Arteaga Jorge. OCT de segmento anterior: Glaucoma, córnea y cristalino. Comunicación Solicitada Sociedad Española de Oftalmología 2016.
- Jarrín E, Jaumandreu L, Leal M, Márquez C, Muñoz Negrete FJ, Rebolleda G. Correlación tomográfico-histológica de imágenes de OCT-SA. OCT segmento anterior: dispositivos, correlación anatómica y principales aplicaciones. Ponencia de la Sociedad Española de Oftalmología. 2011.
- Muñoz Negrete FJ, Rebolleda G, Díaz Llopis M, Eds. Tomografía de coherencia óptica Madrid; Sociedad Española de Oftalmología. 2011; Cap 9.1; pp: 187-192.
- Pavlin C. J, Harasiewicz K, and Foster F S.: Ultrasound biomicroscopy of anterior segment structures in normal and glaucomatous eyes. Am J Ophthalmol. 1992; 113: 381-389.
- Cheung CY, Zheng C, Ho CL. Novel anterior chamber angle measurements by high definition optical coherence tomography using the Schwalbe line as the landmark. Br J Ophthalmol. 2011. 95(7): 955-959.
- Fernández-Vigo JI, Fernández-Vigo C, Martínez de la Casa JM, Sáenz-Francés F, Santos-Bueso E, García-Feijoó J, Fernández-Vigo JA. Identificación de estructuras del ángulo iridocorneal mediante tomografía de coherencia óptica Fourier Domain. Arch Soc Esp Oftalmol. 2016; 91: 74-80.
- Nakabayashi S, Kawai M, Yamaguchi T, et al. Patency of small laser iridotomy evaluated using anterior segment optical coherence tomography. Clin Ophthalmol. 2014 Mar 21; 8: 595-7.
- Meziani L, Tahiri Joutei Hassani R, El Sanharawi M, Brasnu E, Liang H, Hamard P. et al. Evaluation of blebs after filtering surgery with En Face Anterior Segment Optical Coherence Tomography: A pilot study. J Glaucoma. 2015.
- Zhang Y, Wu Q, Zhang, M, Song B, Du X ,LU B. Evaluating subconjunctival bleb function after trabeculectomy using slit-lamp optical coherence tomography and ultrasound biomicroscopy. Chin Med J (Engl). 2008; 121(14): 1274-9.
- Sng CC, Singh M, Chew PT, Ngo CS, Zheng C, Tun TA et al. Quantitative assessment of changes in trabeculectomy blebs after laser suturelysis using anterior segment coherence tomography. J Glaucoma. 2012; 21(5): 313-7.
- Guthoff R, Guthoff T, Hensler D, Grehn F, Klink T. Bleb needling in encapsulated filtering blebs: evaluation by optical coherence tomography. Ophthalmologica. 2010; 224(4): 204-8.
- P. Bañeros-Rojas, J.M. Martinez de la Casa, P. Arribas-Pardo, C. Berrozpe-Villabona, P. Toro Utrera, J. García-Feijoó. Concordancia entre la tonometría de Goldmann, Icare Pro y Corvis ST. Arch Soc Esp Oftalmol 2014;89:260-4.
- Luce DA. Determining the in vivo biomechanical properties of the cornea with an ocular response analyzer. J Cataract Refract Surg 2005; 31: 156-162.
- David A. Luce, Determining in vivo biomechanical properties of the cornea with an ocular response analyzer, In Journal of Cataract & Refractive Surgery, Volume 31, Issue 1, 2005, Pages 156-162.
- Shah S, Laiquzzaman M, Cunliffe I, Mantry S. The use of the Reichert ocular response analyzer to establish the relationship between ocular hysteresis, corneal resistance factor and central corneal thickness in normal eyes. Cont Lens Anterior Eye 2006; 29: 257-62.
- Jose M. Martinez de la Casa, Julian Garcia-Feijoo, Ana Fernandez Vidal, Carmen Mendez Hernandez, Julian Garcia Sanchez; Ocular Response Analyzer versus Goldmann Applanation Tonometry for Intraocular Pressure Measurements. Invest. Ophthalmol. Vis. Sci. 2006;47(10):4410-4414.
- Vandewalle E, Vandenbroeck S, Stalmans I, Zeyen T. Comparison of ICare, dynamic contour tonometer, and ocular response analyzer with Goldmann applanation tonometer in patients with glaucoma. Eur J Ophthalmol. 2009 Sep-Oct;19(5):783-9.
- Hong J, Xu J, Wei A, Deng S, Cui X, Yu X et al. A new tonometer—the Corvis ST Tonometer clinical comparison with non-contact, and Goldmann applanation tonometers. Invest Ophthalmol Vis Sci. 2013:659–65, 12-10984.
- Brandt JD et al. Six-Month Intraocular Pressure Reduction with a Topical Bimatoprost Ocular Insert: Results of a Phase II Randomized Controlled Study. Ophthalmology. 2016 Aug;123(8):1685-94.
- Lewis RA et al. Bimatoprost Sustained-Release Implants for Glaucoma Therapy: 6-Month Results From a Phase I/II Clinical Trial. Am J Ophthalmol. 2017 Mar;175:137-147.
- Ciolino JB et al. In vivo performance of a drug-eluting contact lens to treat glaucoma for a month. Biomaterials. 2014 Jan;35(1):432-9.
- Garnock-Jones KP. Ripasudil: first global approval. Drugs. 2014 Dec;74(18):2211-5.
- Lin CW, Sherman B, Moore LA, Laethem CL, Lu DW, Pattabiraman PP, Rao PV, deLong MA, Kopczynski CC. Discovery and Preclinical Development of Netarsudil, a Novel Ocular Hypotensive Agent for the Treatment of Glaucoma. J Ocul Pharmacol Ther. 2017 Jun 13.
- Andrés-Guerrero V, Zong M, Ramsay E, Rojas B, Sarkhel S, Gallego B, de Hoz R, Ramírez AI, Salazar JJ, Triviño A, Ramírez JM, Del Amo EM, Cameron N, de-Las-Heras B, Urtti A, Mihov G, Dias A, Herrero-Vanrell R. Novel biodegradable polyesteramide microspheres for controlled drug delivery in Ophthalmology. J Control Release. 2015 Aug 10;211:105-17. doi: 10.1016/j.jconrel.2015.05.279. Epub 2015 May 21.
- Quinteros D, Vicario-de-la-Torre M, Andrés-Guerrero V, Palma S, Allemandi D, Herrero-Vanrell R, Molina-Martínez IT. Hybrid formulations of liposomes and bioadhesive polymers improve the hypotensive effect of the melatonin analogue 5-MCA-NAT in rabbit eyes. PLoS One. 2014 Oct 20;9(10):e110344.
- Fedorchak MV, Conner IP, Schuman JS, Cugini A, Little SR. Long Term Glaucoma Drug Delivery Using a Topically Retained Gel/Microsphere Eye Drop. Sci Rep. 2017 Aug 17;7(1):8639.
- O'Callaghan J, Cassidy PS, Humphries P. Open-angle glaucoma: therapeutically targeting the extracellular matrix of the conventional outflow pathway. Expert Opin Ther Targets. 2017 Nov;21(11):1037-1050.
- O'Callaghan J, Crosbie DE, Cassidy PS, Sherwood JM, Flügel-Koch C, Lütjen-Drecoll E, Humphries MM, Reina-Torres E, Wallace D, Kiang AS, Campbell M, Stamer WD, Overby DR, O'Brien C, Tam LCS, Humphries P. Therapeutic potential of AAV-mediated MMP-3 secretion from corneal endothelium in treating glaucoma. Hum Mol Genet. 2017 Apr 1;26(7):1230-1246.