Estudio genético del melanoma de coroides: valoración pronóstica
Amparo Navea, Jorge Mataix
FISABIO Oftalmología.
UCH CEU. Valencia
Un cáncer, sea del tipo que sea, se produce cuando un grupo de células empiezan a proliferar de manera descontrolada y autónoma, invadiendo el propio tejido u otros. La causa de este «descontrol» son procesos mutacionales que ocurren en el ADN de dichas células. Las mutaciones pueden estar causadas por agentes externos o internos y aparecen habitualmente después del nacimiento.
Origen del cáncer
La causa de las mutaciones es poco conocida, algunas si lo son: tabaco, ultravioletas. Pero en general se sabe relativamente poco sobre las causas y mecanismos de este proceso y si bien no podemos identificarlo perfectamente, si que podemos detectar la llamada «huella» o «firma» en algunos casos.
Cada mutación tiene un patrón particular, una huella, en el genoma del cáncer que haya originado. Se ha identificado la mayoría de estas huellas dactilares que explican la historia de cada cáncer, lo que nos permite tratar de comprenderlos. Las huellas detectadas explican la mayoría de las mutaciones encontradas en los tipos de cáncer mas comunes.
Estas huellas o patrones no son más que secuencias determinadas de nucleótidos que se encuentran repetidas en muchos de los tumores estudiados.
En 2013 se publico en Nature (1) los resultados de un gran estudio de mutaciones en mas de 7000 canceres donde se encontraron mas de 20 tipos distintos de «firmas mutacionales». Algunas se asocian con la edad, exposición a mutágenos conocidos (tabaco ultravioletas o defectos en el mantenimiento del DNA), muchas son de origen desconocido. Se describe también que todos los canceres tienen 2 o mas huellas/firmas, lo que refleja la variedad de procesos que influyen durante el desarrollo. Diferentes canceres tienen diferente número de procesos mutacionales: el de ovario dos, el de hígado 6. Algunas huellas se encuentran en múltiples tipos de cáncer, otras solo en uno.
La importancia del hallazgo radica en que, por ejemplo, algunos de estos patrones mutacionales característicos se encuentran en muchos tipos de tumores lo que significa que todos ellos tienen un proceso biológico común. Pero también han encontrado que otros tumores presentan 2 de estos patrones, lo que significa que están causados por un número limitado de mecanismos, acercándonos mucho a la causa o causas de dicho tumor.
En el Melanoma se han encontrado 3 firmas mutacionales:
- Firma 1B común a otros 19 cánceres.
- La firma 7 común a cáncer de cabeza y cuello.
- La 11 común al glioblastoma.
El melanoma uveal (MU)
Es un tumor que surge de células de la úvea y metastatiza en el hígado. El melanoma ocular es como el cutáneo en cuanto a morfología celular, expresión de marcadores melanociticos, propensión a metastatizar y resistencia a tratamientos. Se diferencia en la localización anatómica en el ojo, separado de epitelios. Por este motivo no le afectan los mismos factores en la diseminación y progresión. Los linfáticos oculares son demasiado pequeños para que pasen las células y por tanto solo metastatiza por vía sanguínea.
Aun así la tasa de mortalidad del MU no ha variado mucho entre 1936-2012, siendo sobre el 35-40%. Resulta curioso que en el 100% de los MU se detectan células malignas circulantes hacia los 7 años de evolución y a pesar de ello la supervivencia es a los 5 años del 65% , a los 10 años del 52% y a los 15 años del 46%. Debe existir algún factor que haga que las células infiltren o no.(2)
Se conoce hace cierto tiempo que la monosomía 3 es el mas claro predictor de metástasis (3).
Solo metastatizan el 5% de los que no tienen la monosomía 3, mientras los positivos a esta anormalidad cromosómica metastatizan en su mayoría.
El MU tiene una inestabilidad genética baja comparado con otros tumores, menos de la mitad que los de mama por ejemplo (4). En la Tabla 1 podemos ver las distintas anomalías cromosómicas que pueden aparecer en los MU.
|
Tabla 1. Alteraciones genéticas más frecuentes en el MU
|
Además del estudio de las anomalías cromosómicas, podemos determinar el llamado «perfil de expresión genética» (PEG) del MU. Son técnicas que estudian la huella o firma genética de las mutaciones del MU, para utilizarlas como factor pronostico. Utilizando la determinación del PEG se han clasificado los MU en (5,6):
- Clase 1 bajo riesgo PEG similar a melanocitos uveales, disomía 3, ganancia 6p y 8q.
- Clase 2 alto riesgo: monosomía 3 perdida 1p y 8p ganancia 8q reducción de la expresión de los genes melanocíticos y se parece células primitivas neurales o ectodermales.
¿Que ventajas tiene la técnica de PEG?
La obtención de marcadores cromosómicos necesita cantidad de tejido (enucleación) pero el 90% de los MU son tratados con braquiterapia actualmente. La muestra por punción suele ser insuficiente, además de que puede haber errores de la muestra debidos a la heterogenicidad intratumoral y por lo tanto es difícil estar seguro de que la información es acertada.
El método del PEG permite determinar que tumores con disomia 3 tienen diferente PEG que los de monosomia 3 y permite la clasificación en clase 1 y 2. La exactitud del diagnostico se ha confirmado en diferentes estudios.
En los tumores de clase 1 el cromosoma 3 suele ser normal. Sin embargo en los de clase 2 suele ser monosómico, y se corresponden con tumores que tienen la mutación del gen BAP1 que se encuentra en el cromosoma 3. Hay descrita una discordancia en un 20% de tumores entre el PEG y monosomia 3, y en este grupo parece que el PEG es mas fiable en cuanto al pronostico (7).
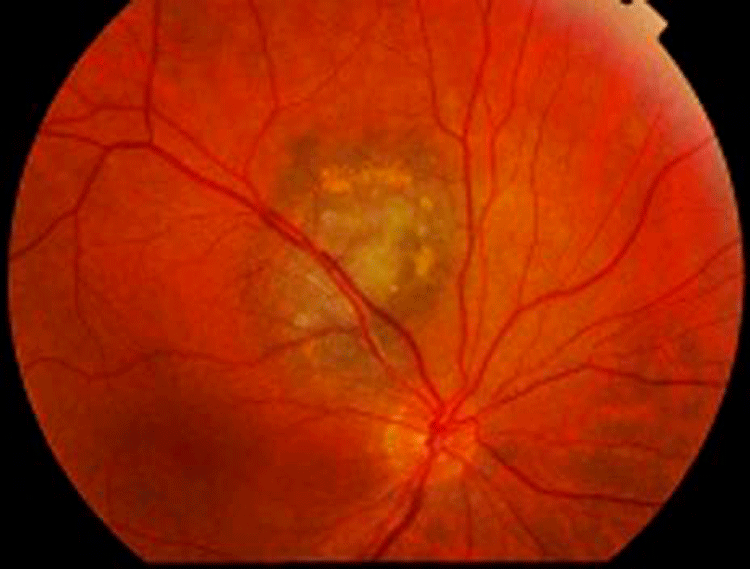
Figura 1. Retinografía color de presunto nevus coroideo.
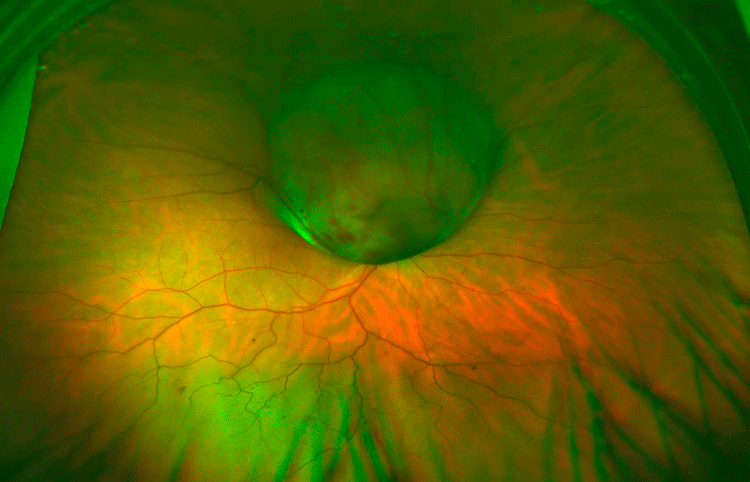
Figura 2. Retinografía de campo amplio del mismo ojo tres años mas tarde, melanoma.
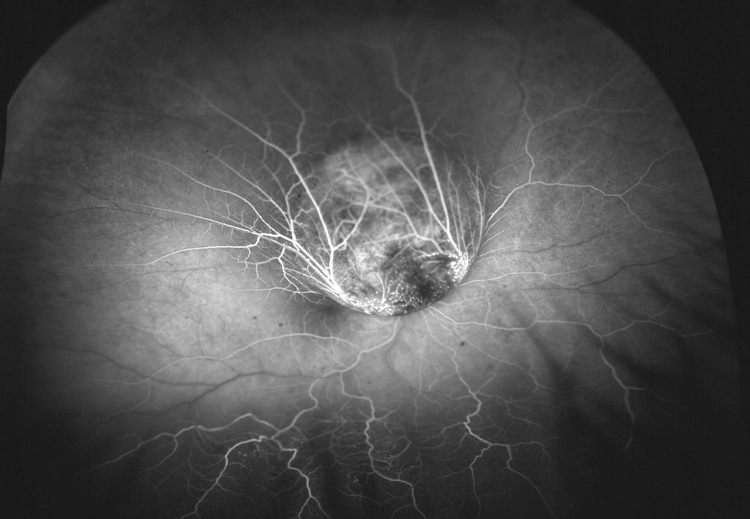
Figura 3. Angiografía con fluoresceína mostrando doble circulación.
Otros posibles marcadores
- El gen BAP1 en el cromosoma 3p21.1, se ha detectado en MU metastásicos y canceres mama, pulmón, mesoteliomas y melanomas cutáneos.
- Mutaciones en los genes GNAQ o GNA11, presentes en muchos MU, codifican subunidades de la proteína G activándola: dejando que todas las formas de señales pasen libremente dentro y fuera de las células. Esto conduce a la sobre-activación de la proteína asociada-Yes (YAP), un potente oncogen que tiene la capacidad de causar cáncer
- YAP es una oncoproteina (de la vía Hippo) y esta activada en muchos canceres humanos. La vía Hippo esta modulada por proteína G y eso sugiere que la vía Hippo puede contribuir al desarrollo de tumores con esa mutación como el MU (8)
Obtención de muestras para el estudio genético
- ANTES DE BRAQUI biopsia-aspiración con aguja fina (BAAF).
- En tejido en parafina post-enucleación.
- En tumor resecado.
Durante los últimos años se han desarrollado diferentes métodos para la determinación de alteraciones genéticas en el MU. Las técnicas más usadas son la hibridación in situ fluorescente (FISH), amplificación dependiente de sondas múltiples, análisis de microsatélites, array/matriz de polimorfismos de un solo nucleótido (SNP: single nucleotide polymorphism) y perfil de expresión génica basado en un ensayo de PCR de 12 genes.
Tests comerciales
- El test basado en el perfil de expresión génica (DecisionDx-UM;) www.castlebiosciences.com/test_UM.html) en la actualidad se usa en unidades de oncología ocular en Norte América.
- El test de sondas mutliplex, MLPA (MRC-Holland; http://www.mlpa.com) (9).
A tener en cuenta
- Los MU son heterogéneos: la muestra no es representative al 100%.
- Se recomienda considerar datos clínicos.
- Y las características histomorfológicas del tumor.
Resumen
- El MU es mortal en un 35-50% y el riesgo de metástasis puede determinarse considerando factores clínicos histomorfológicos y genéticos.
- La monosomía 3 y la polisomía 8q se asocian con mal pronóstico, al igual que el PEG clase 2.
- Se están investigando biomarcadores serológicos sin aplicación clínica por ahora.
Bibliografía
- Alexandrov LB et al. Signatures of mutational processes in human cancer. Nature. 2013 Aug 22; 500(7463): 415-21. doi: 10.1038/nature12477. Epub 2013 Aug 14.
- Miyamoto C Balazsi M..Burnier MN Uveal melanoma: ocular and systemic disease. Saudi J ophthalmol. 2012 26:145-149.
- Sandinha MT, Farquharson MA, McKay IC, Roberts F.Monosomy 3 predicts death but not time until death in choroidal melanoma. Invest Ophthalmol Vis Sci. 2005 Oct; 46(10): 3497-501.
- Harbour JW The genetics of uveal melanoma: an emerging framework for targeted therapy. Pigment Clee Melanoma Res. 2012; 25: 171-181.
- Harbour JW. Update in uveal melanoma. Clin Adv Hematol Oncol. 2012 Jul; 10(7): 459-61.
- Onken MD, Worley LA, Ehlers JP, Harbour JW. Gene expression profiling in uveal melanoma reveals two molecular classes and predicts metastatic death. , Cancer Res. 2004 Oct 15; 64(20): 7205-9.
- Harbour JW The genetics of uveal melanoma: an emerging framework for targeted therapy. Pigment Clee Melanoma Res. 2012; 25: 171-181.
- Guan KL, 2014 YAP as oncotarget in uveal melanoma. Oncoscience 2014:480-481.
- Harbour, J. W. A prognostic test to predict the risk of metastasis in uveal melanoma based on a 15-gene expression profile. Methods Mol. Biol. 2014; 1102: 427-40.