Anti-VEGF. ¿Qué es un anti-VEGF? Riesgo sistémico. Relación riesgo-beneficio
Josefina Bañuelos Bañuelos; Sofía de Manuel Triantafilo; Alfonso Arias Puente
Antiangiogénicos y patología tumoral sistémica
La angiogénesis es un proceso mediante el cual los vasos crecen y se perfecciona. Este proceso está controlado por moléculas proangiogénicas y moléculas inhibidoras.
El factor de crecimiento vascular (VEGF) es la principal molécula proangiogénica. Los tumores sólidos producen VEGF al precisar de vascularización propia para crecer y diseminarse. El desarrollo de estos fármacos se ha iniciado ante la necesidad de controlar la angiogénesis en los procesos tumorales.
La quimioterapia (QT) en los tratamientos oncológicos está limitada por su falta de especificidad al dañar, además de las células cancerígenas, a las células normales. Es por ello que las terapias oncológicas actuales van dirigidas a disminuir la toxicidad y mejorar la calidad de vida de los pacientes.
Los fármacos antiangiogénicos han sido diseñados para impedir que se formen vasos sanguíneos nuevos y así detener el crecimiento y la diseminación de los tumores. Si se asocian estos fármacos con dosis sub-óptimas y continuas de quimioterapia se puede lograr mejorar la supervivencia, disminuir la toxicidad y por lo tanto mejorar también la calidad de vida del paciente con patología tumoral metastásica.
El modo de actuación de estos fármacos es:
- Inhiben la síntesis de proteínas angiogénicas por las células tumorales.
- Neutralizan proteínas angiogénicas.
- Inhiben los receptores del endotelio para las proteínas angiogénicas.
- Inducen apoptosis de células endoteliales.
Estos fármacos han sido aprobados asociado a quimioterapia para el tratamiento de tumores sólidos con metástasis: Cáncer metastásico de colon y recto, carcinoma de células renales metastásico, carcinoma de mama metastásico, carcinoma de pulmón microcítico avanzado no resecable metastásico o recidivante, carcinoma de ovario avanzado y glioblastoma.
Efectos adversos de los antiangiogénicos en los tratamientos sistémicos: Mecanismo de acción.
La figura 1 representa un esquema de los mecanismos de producción de los efectos secundarios de los fármacos antiangiogénicos más frecuentemente utilizados en oncología. Estos eventos además varían en relación con las dosis y con la patología sistémica asociada en los pacientes con cáncer metastásico.
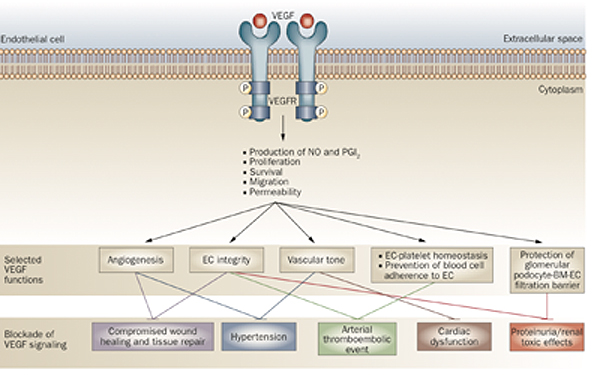
Figura 1: Eventos sistémicos provocados por el bloqueo del VEGF (Nat. Rev. Clin. Oncol. 6, 465–477: 2009).
• Hipertensión arterial: La inhibición del receptor VEGFR2 va a producir una disminución del óxido nítrico y de la síntesis de prostaglandinas I2: Esto conlleva a la inhibición de la vasodilatación inducida por las células endoteliales con aumento de la resistencia vascular. Además induce rarefacción de la densidad capilar y arteriolar. Esta complicación aparece en el 32% de los pacientes, es dosis dependiente y se controla con tratamiento médico. Se presenta con más frecuencia en pacientes con HTA previa.
• Efectos tromboembólicos arteriales: La formación de trombos está favorecida por la apoptosis de células endoteliales, la alteración de la homeostasia de las células endoteliales-plaquetas, y por la exposición de matriz extracelular a los vasos sanguíneos. Se manifiesta con isquemia cardíaca y cerebral pudiendo presentar también trombosis aórtica y de arterias periféricas. La incidencia de estos eventos en los tratamientos con QT aislada es del 1,7% aumentando al 3,8% cuando se asocian QT y Anti-VEGF. Esta complicación es dosis dependiente, más frecuente en mayores de 65 años y cuando tienen historia previa de fenómenos tromboembólicos.
• Disfunción ventricular e insuficiencia cardíaca congestiva: Provocado por el aumento de las resistencias periféricas, inhibición del crecimiento de los cardiomiocitos y cambios isquémicos en arterias coronarias. Esta evento se ha visto significativamente aumentado cuando se asocia QT+ AntiVEGF + Antraciclina en el tratamiento del cáncer de mama metastásico.
• Eventos tromboembólicos venosos: Su presencia aumenta desde un 4,9% en los pacientes con QT aislada hasta un 7,8% cuando se asocia QT + AntiVEGF.
• Reacciones de hipersensibilidad: Presentes en un 5% de los pacientes.
• Proteinuria: Producida por la pérdida de las defenestraciones endoteliales y pérdida de podocitos, endoteliosis y microangiopatía trombótica renal. Aparece entre el 0,7%-38% de los pacientes. Refleja la importancia del VEGF en la función renal. Es dosis dependiente, reversible y benigna. Menos de un 0,5% de los pacientes evolucionan aun síndrome nefrótico.
• Hemorragias: El sangrado mucocutaneo se puede presentar en el 50% de los pacientes. Hemorragias asociadas a los tumores pulmonares y gastrointestinal se ven en el 0,4-6% de pacientes y un 9% pueden ser hemorragias graves.
• Perforación gastrointestinal: Presente entre el 1%-2%.
• Complicaciones en la cicatrización de las heridas: Puede ser importante a la hora de valorar cirugías ya que se presentan en el 10%-20% de los pacientes. Por ello no se debe de realizar cirugía hasta 28 días después de suspender la medicación.
• Leucoencefalopatía posterior reversible: Se puede manifestar como cefaleas, cambios del comportamiento, convulsiones, ceguera cortical, infarto y hemorragia. No está relacionado con la dosis, es reversible y se presenta como un edema subcortical ocipito-parietal. Se puede atribuir a la encefalopatía hipertensiva y disfunción endotelial, que favorece la rotura de la barrera sangre-cerebro con edema cerebral focal y vasoespasmo. Aunque pueden ser producido por inhibición del VEGF, no ha podido ser reproducido en modelos preclínicos.
Antiangiogénicos y oftalmología
El primer anti-VEGF aprobado para uso intraocular ha sido el Pegaptanib comercializado como Macugen y aprobado por la FDA en el año 2004. Posteriormente se realizan los estudios con Ranibizumab que se comercializa como Lucentis y es aprobado por la FDA en junio de 2006 y por la EMEA en enero de 2007. El Aflibercept comercializado como EYLEA es aprobado para uso intraocular por la FDA en noviembre de 2011 y por la EMEA en noviembre de 2012.
El Bevacizumab se aprobó para el tratamiento del cáncer de colon metastásico en el 2004. A partir del año 2005 fue utilizado intraocular de forma generalizada como uso compasivo. En la actualidad el Avastin se sigue utilizando en la practica clínica como uso fuera de indicación.
Tanto el Ranibizumab como el Aflibercept han demostrado un nivel de evidencia alto en relación con el grado de eficacia y seguridad. En los estudios VIEW 1 y VIEW 2 la eficacia y seguridad del Aflibercept es similar al Ranibizumab.
La eficacia y seguridad del Bevacizumab han sido evidenciadas en los ensayos clínicos CATT e IVAN. Se ha demostrado que la eficacia es igual al ranibizumab. Sin embargo, al valorar la seguridad si se han hallado diferencias con una mayor incidencias de eventos adversos bevacizumab .
Efectos adversos sistémicos asociados al tratamiento intravítreo
Los efectos adversos sistémicos asociados al uso intraocular del fármaco los tenemos que valorar desde la perspectiva de la dosis. Si en el uso sistémico las dosis son de 5-15 mg/Kg cada 2 semanas y el intraocular varia entre 0,5-2 mg cada 4/8 semanas, los eventos sistémicos asociados a las dosis intraocular van a ser difícil de ponderar.
En el estudio CATT a los 2 años se encontró una mayor incidencia de efectos adversos sistémicos graves para el bevacizumab (fig. 2). El estudio IVAN en el primer año no encontró diferencias de efectividad y seguridad entre los dos fármacos. Incluso mostro una incidencia riesgo aumentado para fallo cardiaco e infarto de miocardio para el Ranibizumab (fig. 3). Lo que si ha demostrado el IVAN es que en los pacientes tratados con Bevacizumab hay una disminución de los valores de VEGF en suero lo que implica una mayor supresión sistémica del VEGF.
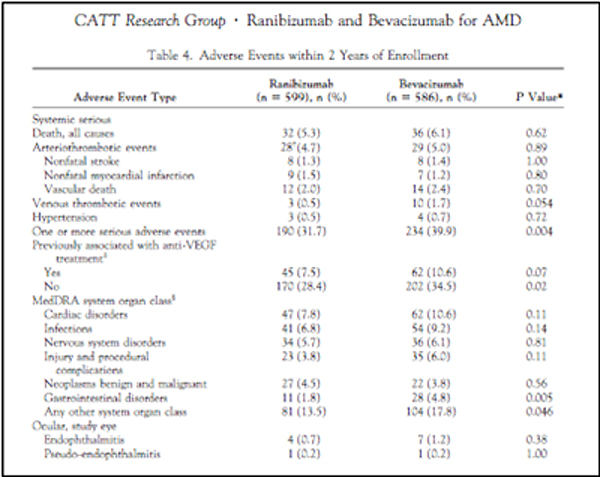
Figura 2: Efectos adversos en el estudio CATT a los 2 años Ophthalmology 2012.
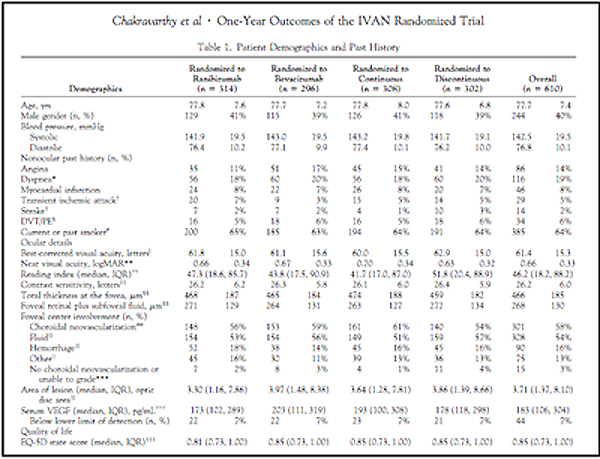
Figura 3: Efectos adversos en el estudio IVAN a los 12 meses. Ophthalmology 2012.
En una revisión publicada en Retina en el 2011 basándose en 270 artículos con 7579 pacientes y un total de 18.385 ojos no hallan suficiente evidencia en la incidencia de efectos adversos entre los diferentes AntiVEGF. Los efectos adversos sistémicos en relación con el número de inyecciones están por debajo del 1% y por debajo de 5% para los eventos oculares (fig. 4), por lo cual se pueden considerar estos fármacos seguros para su uso intraocular.
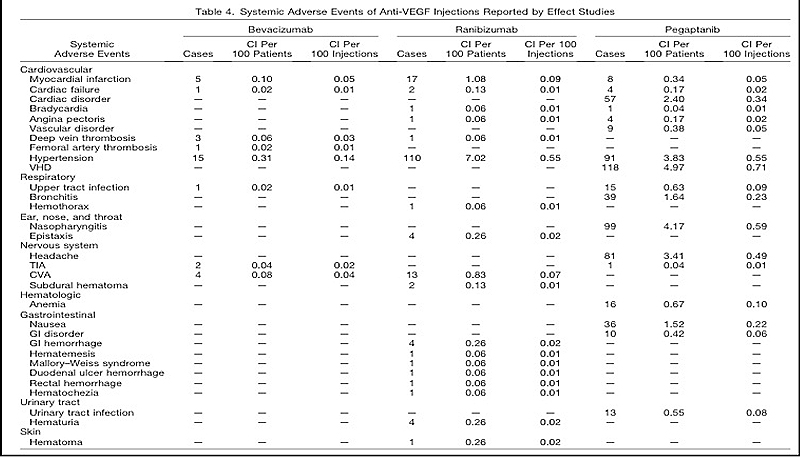
Figura 4: A systematic review of the adverse events of intravitreal anti–vascular endothelial growth factor injections Retina 2011.
La edad y la co-morbilidad en los pacientes con DMAE hace difícil valorar los eventos sistémicos que aparecen durante los multiples tratamientos intravitreos con Anti-VEGF. Además los pacientes con patología cardiovascular presentan un riesgo aumentado de DMAE. Las patologías sistémicas como la diabetes y la HTA, que son un factor de riesgo de edema macular y de oclusiones vasculares venosas retinianas, tiene también aumentada la incidencia de eventos cardiovasculares y tromboembólicos.
El mayor interés con respecto a los eventos sistémicos asociados a las inyecciones intravítreas de Anti-VEGF es buscar el fármaco con un mayor perfil de seguridad.
Efectos adversos oculares asociados al tratamiento intravítreo
Se pueden asociar al propio fármaco pero la mayoría se deben al acto quirúrgico. Los mas importantes y frecuentes son:
- Endoftalmitis: La incidencia es muy baja y se considera inferior al 0.04 %. Fundamentalmente por gérmenes gram +. No se ha demostrado que el uso de Ab modifique la incidencia. Al ser tan baja la incidencia por inyección impide hacer un ensayo clínico válido. El uso de povidona iodada, evitar la manipulación de párpados y conjuntiva y uso de Ab inmediatamente después de la inyección puede disminuir el riesgo. La fragmentación de los fármacos podría considerarse un riesgo aumentado de contaminación y posibilidad de infección intraocular.
- Desprendimiento de retina: La incidencia acumulativa en pacientes con DMAE es del 0,01%, aumentando al 5,2% en pacientes con retinopatía diabética proliferante. Si es frecuente el desprendimiento de vítreo posterior y aparición de moscas volantes.
- Atrofia geográfica: Se ha visto una mayor incidencia aunque los datos son poco valorables en el uso de dosis mensuales de ranibizumab.
- Rotura de epitelio pigmentario (EP): Aunque la rotura de EP puede presentarse de forma espontanea en los pacientes con DMAE + Desprendimiento de EP (DEP), si que se ha visto un aumento de la incidencia de roturas de EP en los pacientes tratados. Esta incidencia varia desde un 0,02 en los pacientes con ranibizumab hasta un 0,27 en los del bevacizumab en los pacientes con DMAE, siendo mucho más alta si hay DEP previo llegando a un 5,37% en aquellos pacientes tratados con Bevacizumab.
- Inflamación en cámara anterior: La presencia de signos inflamatorios en cámara anterior ha sido descrita con mayor frecuencia en los pacientes tratados con ranibizumab.
- Catarata: La incidencia acumulativa de progresión de catarata es del 0,05%-0,17%. La lesión traumática accidental se considera un evento grave que esta en relación con la técnica y que se ha visto con una incidencia del 0,01%-0,04%.
- Hipertensión ocular: La tensión intraocular puede aumentar en los primeros 30 min y luego se normaliza en un 0,15%-0,5% no precisando tratamiento hipotensor.
- Hemorragia intraocular: La incidencia de hemorragia intraocular es entre un 0,0%-0,3%. Podría estar relacionado con la técnica quirúrgica, el propio acto quirúrgico o por el Anti-VEGF. Las agujas actuales de 32G minimizan este riesgo. Se puede manifestar como hemorragia vítrea o en algunos casos sangrado macular. El riesgo de complicaciones hemorrágicas en pacientes anticoagulados o antiagregados es muy bajo, considerándose mayor y mas grave el riesgo sistémico al suspender la terapia.
- Efectos adversos leves-moderados: La incidencia puede ser superior al 5% y entre otros están la hemorragia subconjuntival, molestias oculares, escozor y dolor ocular. Las agujas con pequeño calibre 32G minimizan estos eventos.
III. Conclusiones
Los predictores de AV y los resultados visuales son similares para los anti-VEGF actuales de uso intraocular. El margen de seguridad es también alto para el uso intraocular. Hay descritos ya factores asociados a mayor ganancia visual y que están en relación con las características de cada paciente: Edad, mejor AV inicial, menor tamaño de la lesión, menor grosor foveal y menor altura del DEP.
A pesar de disponer de fármacos con alto nivel de efectividad y seguridad, es importante el seguir buscando el anti-VEGF que ofrezca a igual efectividad una mayor seguridad, precise de menor número de inyecciones y presente una relación coste-efectividad asequible para los sistemas sanitarios.
Todos los pacientes a pesar de tener factores de predicción de mal pronóstico experimentan mejoría, por lo que se deben de considerar el tratamiento a pesar de las escasas expectativas visuales.
Los beneficios visuales obtenidos en el tratamiento de la patología ocular con anti-VEGF son muy superiores a los riesgos oculares y a los teóricos riesgos sistémicos.
Bibliografía
- Anti-Angiogenic Therapeutic Drugs for Treatment of Human Cancer. Han-Chung Wu, Chia-Ting Huang, and De-Kuan Chang. J. Cancer Mol. 4(2): 37-45, 2008.
- Mechanisms of adverse effects of anti-VEGF therapy for cáncer. T. Kamba and DM. McDonald. British Journal of Cancer T (2007) 96, 1788 – 1795.
- Adverse effects of anticancer agents that target the VegF pathway Chen, H. X. Cleck, J. N. Nat. Rev. Clin. Oncol. 6, 465–477 (2009).
- Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration The CATT Research Group* N Engl J Med 2011; 364: 1897–908.
- Comparison of Age-related Macular Degeneration Treatments Trials (CATT) Research Group, Martin DF, Maguire MG, Fine SL, Ying GS, Jaffe GJ, Grunwald JE, Toth C, Redford M, Ferris . Ophthalmology. 2012 Jul; 119(7): 1388-98.
- Ranibizumab versus bevacizumab to treat neovascular age-related macular degeneration. One-year findings from the IVAN randomized trial. Chakravarthy U, Harding SP, Rogers CA, et al. Ophthalmology 2012; 119: 1399–1411.
- Intravitreal Aflibercept (VEGF Trap-Eye) in Wet Age-Related Macular Degeneration Jeffrey S. Heier, David M. Brown, and col. for the VIEW 1 and VIEW 2 Study Groups* Ophthalmology. 2012 Dec; 119(12): 2537-48.
- A systematic review of the adverse events of intravitreal anti–vascular endothelial growth factor injections. Margriet I. Van Der Reis, Ellen C. La Heij, Yvonne De Jong-Hesse, Peter J. Ringens, Fred Hendrikse, Jan S. A. G. Schouten. Retina 31: 1449–1469, 2011.
- Complications of intravitreal injections. Kapil M Sampat and Sunir J Garg. Curr Opin Ophthalmol 21: 178-183, 2010.
- Endophthalmitis Is Not a «Never Event». Andrew P. Schachat, MD Philip J. Rosenfeld, MD; Thomas J. Liesegang, MD -Michael W. Stewart, MD Ophthalmology: 119-8; 2012.
- Incidence of hemorrhagic complications after intravitreal bevacizumab (avastin) or ranibizumab (lucentis) injections on systemically Anticoagulated patients. John O. Mason, Iii, Paul A. Frederick, Michael G. Neimkin, Milton F. White, Jr, Richard M. Feist, Martin L. Thomley, Michael A. Albert, Jr,. RETINA 30: 1386–1389, 2010.
- Safety of Intravitreal Injections in Patients Receiving Warfarin Anticoagulation Pouya N. Dayani, Omar K. Siddiqi, and Nancy M. Holekamp AJO Sep 2007.
- Risk of Geographic Atrophy in the Comparison of Age-related Macular Degeneration Treatments Trials. Juan E. Grunwald, Ebenezer Daniel, Jiayan Huang, Gui-shuang Ying, Maureen G. Maguire, Cynthia A. Toth, Glenn J. Jaffe, Stuart L. Fine, Barbara Blodi, Michael L. Klein, Alison A. Martin, Stephanie A. Hagstrom, Daniel F. Martin, for the CATT Research Group* Ophthalmology 2013.
- Baseline Predictors for One-Year Visual Outcomes with Ranibizumab or Bevacizumab for Neovascular Age-related Macular Degeneration.Comparison of Age-Related Macular De Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Ophthalmology 2013; 120: 122–129.