Antiagregantes y anticoagulantes,¿qué son y para qué sirven?Utilización y prácticas de uso en Oftalmología
J.A. TINTÓ DEL VAL, J.L. URCELAY SEGURA
En la hemostasia intervienen dos sistemas diferentes y complementarios en el control de la hemorragia. La hemostasia primaria es la mediada fundamentalmente por las plaquetas y se encarga, inicialmente, de crear un agregado plaquetario, el llamado «trombo blanco», una vez ocurrida la lesión tisular. A partir de este momento interviene la hemostasia secundaria, mediada por el sistema de los factores de la coagulación, que consolida el proceso convirtiendo el trombo inicial en «trombo rojo».
De modo didáctico podemos resumir que la trombosis arterial depende de los trombos blancos y se evita con antiagregantes plaquetarios, mientras que la trombosis venosa está mediada por los trombos rojos y se previene con anticoagulantes.
| Zona venosa | Zona arterial |
| Baja presión | Alta presión |
| Trombo rojo | Trombo blanco |
| Rico en fibrina | Pobre en fibrina |
| Pobre en plaquetas | Rico en plaquetas |
| Extremos friables | Compacto |
| Fragmentación | Desprenden |
| Embolismo pulmonar | Embolias sistémicas |
Es a estos 2 niveles donde actúan preferentemente los 2 grupos de fármacos antihemostáticos. Sus indicaciones son muchas y son empleados por un número cada vez mayor de pacientes. Pueden suponer un problema quirúrgico añadido si no se manejan cuidadosamente, pues favorecen las complicaciones hemorrágicas intra y postquirúrgicas. Por otra parte, un inadecuado manejo de estos fármacos puede ser causa de accidentes tromboembólicos en estos pacientes.
Tipos de fármacos antihemostáticos:
I. Antiagregantes plaquetarios
Evitan la formación del trombo blanco al impedir la adhesión plaquetaria y la liberación de sustancias que desencadenan su agregación.
El control de su acción se realiza mediante el «Tiempo de hemorragia».
Por su mecanismo de acción existen 2 grupos fundamentales (aunque existen otros, en la práctica éstos son los más empleados):
- Acido acetil salicílico: ASPIRINA®, ADIRO®, TROMALYT®. (Similar a estos es el Triflusal (DISGREN®)
- Clopidogrel (más potentes): PLAVIX®, ISCOVER®
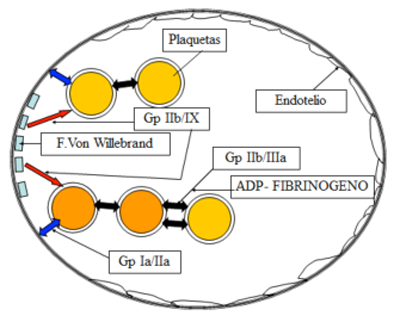
El AAS actúa inhibiendo al ADP-FIBRINÓGENO. La acción del Clopidogrel se localiza en el Gp IIb/IX.
Tienen diferente mecanismo de acción y con ello difiere también su intervalo de latencia y el tiempo necesario para revertir su acción al ser suspendidos y devolver con ello el tiempo de hemorragia al 100% de actividad.
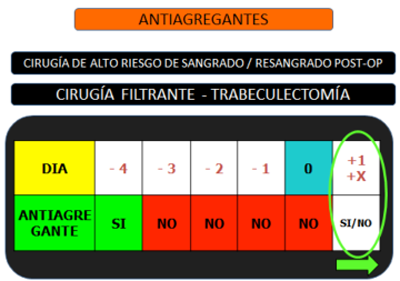
Hay que destacar que no es imprescindible una inactividad total para llevar a cabo una cirugía con seguridad, y valores del 60-70% son suficientes. Ambos grupos pueden ser suspendidos 3-4 días antes de la intervención, con lo que se devuelve el tiempo de hemorragia a esas cifras.
Tras la cirugía se reintroducen 24 horas después. Este tiempo es suficiente pues ya se habrá creado el trombo blanco y no hay repercusión por volver a prolongar el tiempo de hemorragia. En caso de no ocurrir sangrado por la antiagregación en las primeras 24 horas, ya no van a sufrir nuevos episodios de sangrado por este motivo. Si a las 24 horas no hay sangrado activo, se puede reiniciar su administración.
Por el contrario, si a las 24 horas se objetiva sangrado activo, puede prolongarse la suspensión: las patologías que indican la antiagregación no suelen ser tan graves como para no permitir la suspensión de hasta 1 semana; esto nos daría hasta 4 días de suspensión post-cirugía. Ese tiempo debería ser suficiente para controlar cualquier sangrado.

II. Anticoagulantes orales
Su efecto anticoagulante se obtiene al inhibir los pasos intermedios de la coagulación (hemostasia secundaria) mediada por los «factores de la coagulación vitamina K dependientes» (la vitamina K actúa como coenzima en algunas reacciones). Esto evita la formación del «trombo rojo».
El control clínico se realiza con el porcentaje de «Actividad de la protrombina» (internacionalizado y homogeneizado en lo que se conoce como «INR»). Para realizar una cirugía con seguridad necesitamos una actividad > 50-60%. En nuestro caso, como medida de seguridad empleamos el valor de referencia del 70% o un INR < de 1,2.
Fármacos
- Acenocumarol (Cumarínicos): SINTROM® (las pautas aquí propuestas son válidas para Sintrom®)
- Dabigatran: PRADAXA®. Comp. de 75, 110 y 150 mgrs.
Inhibidor competitivo de trombina.
Efecto máximo a las dos horas. Dos dosis diarias. Efecto 12-24 h.
Suficiente suspensión 24 horas
Seguro. No precisa controles (APTT).
Requiere ajuste de dosis en IRC y en mayores de 75 años.
Antídoto: plasma o Factor VIIa recombinante
- Rivaroxaban: XARELTO®. Comp. de 15 y 20 mgrs.
Inhibidor competitivo del Factor Xa.
Efecto máximo a las 4 h. Una dosis diaria. Efecto durante 18 h.
Suficiente suspensión 24 h.
Seguro. No precisa controles (APTT).
No precisa ajustes en IRC leve ni en mayores de 75 a.
No antídoto (plasma?)
Las patologías que indican la anticoagulación son más graves (fibrilación auricular embolígena, valvuloplastias o IAM recurrentes), lo que implica un alto riesgo en caso de suspensión de la medicación. Por eso motivo, el planteamiento en este caso es diferente y lo indicado NO es SUSPENDER el tratamiento anticoagulante, sino su SUSTITUCIÓN por otro fármacos de más ágil manejo. El SINTROM tarda días en aclararse, ya que se une a receptores y su actividad no cesa hasta pasadas del orden de 72 horas.
El Acenocumarol no tiene «antídoto». Su acción es irreversible. No hay forma de revertir sus efectos una vez establecidos SALVO con la transfusión de plasma fresco (des-)congelado que aporte factores de coagulación (medida cara y excepcional).
Se sustituye por sustancias Heparinoides:
- Heparina sódica o Heparina no fraccionada (HNF):
Es la clásica; se administra intravenosa cada 6 horas; difícil de ajustar la dosis. Por ese motivo no se usa salvo en situaciones excepcionales (pacientes de muy alto riesgo).
- Heparinas de Bajo Peso Molecular (HBPM) o fragmentadas:
Estas son las más extendidas; vía subcutánea (permite auto-administración):
-
- Enoxaparina y similares (1.ª generación): CLEXANE®.
-
- Bemiparina (2.ª generación): HIBOR®.
Esta sustitución se debe a que, en caso de necesidad, las heparinas SI tienen antídoto: el SULFATO DE PROTAMINA, que es accesible, manejable fácilmente, y seguro, lo que permite que en caso de presentarse algún problema hemorrágico en el paciente, podamos revertir el efecto anticoagulante sin dificultad.
La pauta habitual empleada es la siguiente:
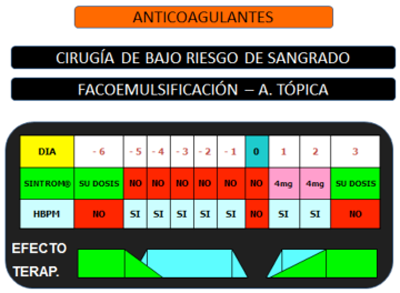
- Independientemente de la patología que lo indique o de la dosis diaria de Sintrom® que se tome, éste se suspende unos días antes, tomando la última dosis el día “-6” antes de la intervención.
- Los días -5,-4,-3,-2, y -1 se administra la HBPM solamente, y no Sintrom®.
- El día de la cirugía: NADA (sin anticoagulante)
- El primer día postoperatorio: HBPM y Sintrom® a “dosis de carga” de 4 mg.
- El segundo día postoperatorio: HBPM y Sintrom® a “dosis de carga” de 4 mg.
- A partir del tercer día: Ya únicamente su dosis habitual de Sintrom®.
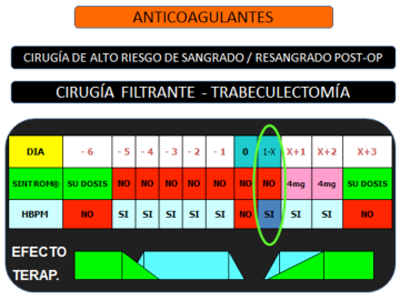
Este pauta puede ser empleada en caso de no existir ninguna complicación hemorrágica que aconseje mantener la pauta de heparinización (y por tanto la capacidad de revertir el efecto).
En caso de complicación hemorrágica y confirmando una buena técnica quirúrgica y un buen estado de las heridas (es decir, descartando una causa directa del problema hemorrágico) y, por tanto, achacándolo a la anticoagulación, lo adecuado es demorar la reintroducción del Sintrom manteniendo, como en el preoperatorio, sólo con HBPM. Cuando entendamos que ha cesado el sangrado activo y el riesgo alto de sangrado, reintroducimos el Sintrom® de la misma manera descrita previamente: 2 días con 4mg de carga+HBPM y a partir del 3º ya únicamente el Sintrom® a su dosis habitual.
Las dosis aconsejadas de HBPM pre y postoperatorias son iguales en todos los pacientes: utilizamos Hibor® a 2500 UI/día. Se pauta 1 vez cada 24 horas. En pacientes de muy alto riesgo que necesitan mucha anticoagulación la dosis deberás ser incrementada (en caso de prótesis cardiacas metálicas antiguas, IAM recurrentes, entre otras situaciones de alto riesgo).