Ozurdex para el tratamiento del edema macular
Alfredo Insausti García, Félix Armadá Maresca, Jesús García Martínez, Mónica Asencio Duran, Gloria Amorena Santesteban, Marisol Calle
I. Introducción
El Ozurdex es un implante de liberación sostenida de dexametasona diseñado específicamente para su inyección intravítrea. Fue aprobado en 2009 por la FDA y en 2010 por la EMA para tratamiento en adultos de (2,3):
- EM secundario a oclusión de rama venosa retiniana (ORVR) u oclusión venosa retiniana central (OVCR).
- Uveítis no infecciosa del segmento posterior.
El principio activo se encuentra en un filamento de polímero biodegradable que se somete lenta y consistentemente a la hidrólisis permitiendo de esta forma la liberación gradual del corticoide en la cavidad vítrea, durante un máximo de 3-6 meses (1). En España comenzó a comercializarse desde principios de 2011.
II. Propósito
Describir la indicación y efectividad del implante intravitreo de Ozurdex en una serie de pacientes con EM tratados en el Hospital Universitario La Paz de Madrid durante el periodo mayo 2011 a febrero 2012.
III. Criterios de Inclusión
Diagnóstico EM independientemente de su causa. Tratamiento 1º en trombosis venosas o uveítis (indicaciones de ficha técnica); tratamiento secundario, en EM refractarios a otras estrategias terapéuticas previas.
Agudeza visual menor de 2/3.
Medida de grosor central retiniano medido mediante OCT >300µ.IV.
IV. Materiales y Método
Serie de casos descriptiva, prospectiva y longitudinal, no controlada de 48 pacientes (50 ojos) con diagnóstico de EM. Exploraciones al mes, 3 y 6 meses tras tratamiento. Seguimiento mínimo de 3 meses y máximo de 12 meses. 8 ojos sometidos a re-tratamiento.
Criterio diagnóstico de EM
- Exploración por lámpara de hendidura con lente Superfield (Volk Optical Inc) o mediante oftalmoscopía indirecta con lente de 20 DO (Volk Optical Inc).
- AFG Y OCT (Cirrus HD-OCT Carl Zeiss Meditec) métodos complementarios para diagnóstico, seguimiento y respuesta al tratamiento.
V. Criterios de Exclusión
- Comorbilidad ocular severa:
- Glaucoma severo (definido como aquel con 2 o más principios activos para controlar la PIO).
- Neuropatías ópticas previas.
- Desprendimiento de retina antiguo con afectación macular.
-Catarata hipermadura que dificultase o no permitiese valorar de forma adecuada la indicación del tratamiento y su seguimiento.
- Uso de corticoesteroides sistémicos, periocular o intraocular en los 30 DÍAS previos a la indicación de Ozurdex.
VI. Análisis
Características de la serie de casos previas al tratamiento
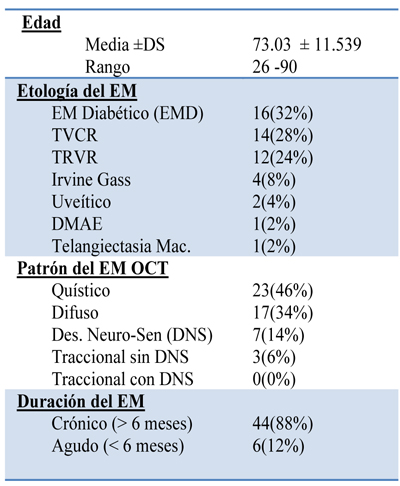
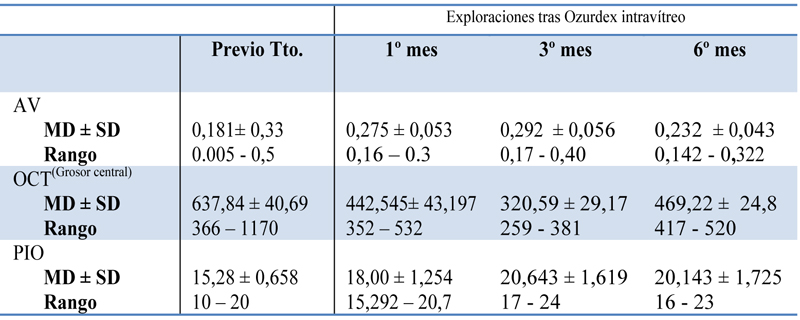
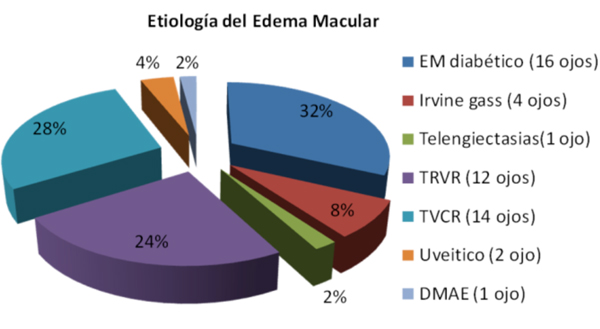
Efectos terapéuticos y secundarios (Casos de 6 meses de evolución)
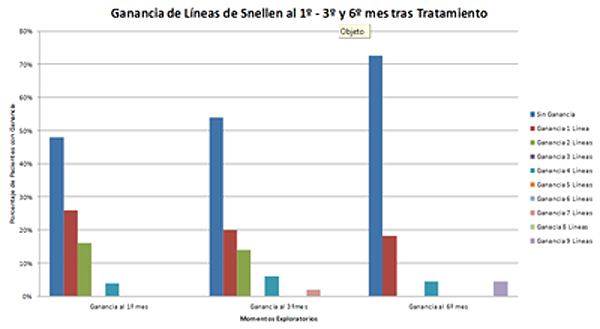
VII. Resultados
- Mejoría estadísticamente significativa en la AV 1º y 3º mes tras el tratamiento (p= <0.001 al primer mes; p=0.001 al tercer mes). No diferencia no estadísticamente significativa al 6º mes.
- Al 1º mes tras el tratamiento en el 52% de los pacientes mejoría visual de al menos una línea de la carta de Snellen, porcentaje que se redujo al 46% en el 3º mes y a 27,3% al 6º mes.
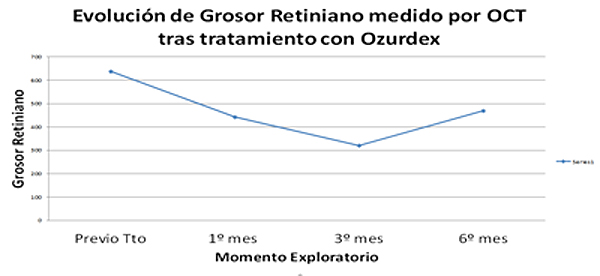
- Disminución estadísticamente significativa en la media del grosor retiniano desde la situación basal (637,84 ± 40,69) al 1º mes (442,545± 43,197, p <0.001), 3º mes (320,59 ± 29,17, p<0.001) y 6º mes (469,22 ± 24,8, p=0.001).
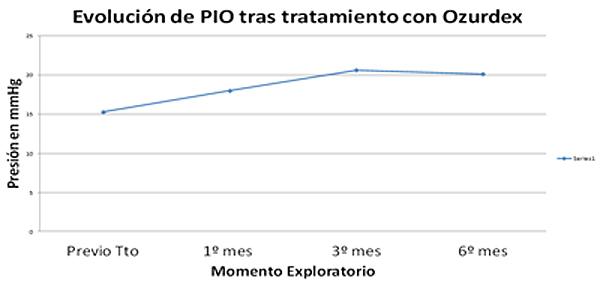
- Aumento de la PIO estadísticamente significativa sólo al tercer mes tras tratamiento. PIO basal 15,28 ± 0,658 mmHg - 3º mes 18,00 ± 1,254 mmHg (p=,002). Aumento de PIO, que requirió tratamiento en 18%. Control de PIO con tratamiento tópico en todos los casos.
- Reacciones adversas: 4% hemorragia en la cavidad vítrea, 2% evolución a cataras. No se produjeron casos de endoftalmitis, desgarros o DR.
Selección de casos
Caso 1: Paciente hombre de 67 años
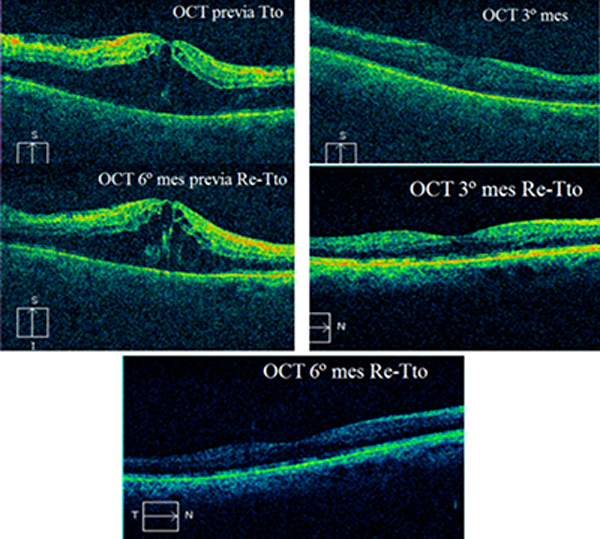
Juicio Clínico: TVCR
AFG: No isquémica
Tto previos: ninguno.
Ozurdex en fase aguda <6 meses
AV previo Tto: 0.015
AV 3º mes: 0.5
AV 6º mes: 0.166
AV 3º mes Re- Tto: 0.33
Av 6º mes Re- Tto y Cirugía de Catarata: 2/3
Caso 2: Paciente mujer de 86 años
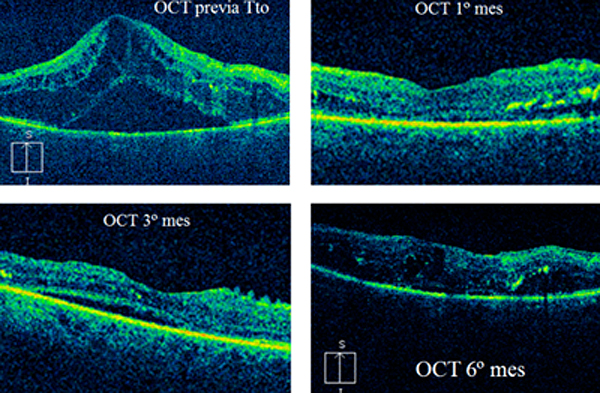
Juicio Clínico: Edema Macular Diabético Crónico
AFG: EM difuso con isquemia macular - ruptura de la ZAF.
Tto previos: Avastin, Vitrectomía
AV previo Tto: 0.125
AV 1º mes: 0.16
AV 3º mes: 0.16
AV 6º mes:0.125
VIII. Conclusiones
Niveles de seguridad y eficacia, comparable al obtenido en otros estudios realizados previamente (2-5). Recuperación de agudeza visual y disminución significativa en el grosor de la retina incluso en pacientes con EM crónico y refractario a otras modalidades terapéuticas.
Bibliografía
- Chang-Lin JE, Attar M, Acheampong AA, et al. Pharmacokinetics and pharmacodynamics of the sustained-release dexamethasone intravitreal implant. Invest Ophthalmol Vis Sci. 2010 August 11.
- Haller JA, Bandello F, Belfort R Jr, Blumenkranz MS, Gillies M, Heier J, Loewenstein A, Yoon YH, Jiao J, Li XY, et al Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion twelve-month study results. Ophthalmology. 2011 Dec; 118(12):2453-60.
- Williams GA, Haller JA, Kuppermann BD, et al. Dexamethasone posterior- segment drug delivery system in the treatment of macular edema resulting from uveitis or Irvine-Gass syndrome. Am J Ophthalmol. 2009;147(6):1048–1054.
- Haller JA, Bandello F, Belfort R Jr, et al. Randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology. 2010;117(6): 1134–1146.
- Cheng CK, Berger AS, Pearson PA, Ashton P, Jaffe GJ Intravitreal sustained-release dexamethasone device in the treatment of experimental uveitis..Invest Ophthalmol Vis Sci. 1995 Feb; 36(2):442-53.