Glaucoma corticoideo en la infancia
Montero M
Madrid
Se caracteriza por un aumento de la PIO tras la administración de corticoides secundario a un aumento en la resistencia de salida del humor acuoso.
Su incidencia es del 30-40% («esteroid responder») en la población normal, y del 90% en los pacientes con glaucoma.
Puede presentarse tras varias vías de administración, siendo la tópica la más frecuente, apareciendo tras varias semanas de administración del fármaco y desapareciendo al retirar el mismo.
Factores de riesgo
• Glaucoma/sospechoso (A su vez, los respondedores tienen alto riesgo de padecer glaucoma).
• Historia previa de respondedor.
• Edad: ≤ 10 años.
Adultos > Jóvenes.
• Enfermedad del tejido conectivo.
• Diabetes Mellitus Tipo 1.
• 1 familiar de primer grado afecto de glaucoma.
• Miopía Magna (>incidencia de glaucoma).
Vías de administración
• LOCAL (ocular): Colirio, Inyecciones (subconjuntival, subtenoniana, vítrea) Pomadas: párpados, oculares.
• SISTÉMICO: Oral, Intravenoso, Tópico: pomadas, inhaladores…
A tener en cuenta:
1. Cuanta mayor sea la POTENCIA del corticoide mayor será el EFECTO HIPERTENSIVO.
2. La DURACIÓN y la SEVERIDAD de la respuesta corticoidea son INVERSAMENTE PROPORCIONALES a la SOLUBILIDAD del fármaco.
Tiempo de respuesta
Puede aparecer desde el 1 DÍA de la administración hasta AÑOS después, pero lo más frecuente es que aparezca tras varias semanas (tópica: 2-6 semanas). Esto depende de varios factores:
• POTENCIA del fármaco.
• VÍA DE ADMINISTRACIÓN (TÓPICA).
• DURACIÓN DEL TRATAMIENTO.
• DOSIS.
• PENETRACIÓN DEL FÁRMACO.
Etiopatogenia
En la malla trabecular existen unos receptores glucocorticoideos que tienen dos isoformas:
• GRα: efectos fisiológicos y farmacológicos del GR.
• GRβ: regulador dominante negativo de la actividad del GR.
En estos pacientes se ha visto que existe una disminución de la isoforma GRβ, que va a producir un aumento de la sensibilidad a los glucocorticoides en las células de la malla trabecular, dando lugar a la expresión del Gen MYOCILIN (Cromosoma 1) = GCL1A, que expresa su proteína, Protein MYOCILIN (TM – inducible glucocorticoid response or TIGR. Esta va a poner en marcha una serie de cambios en la malla trabecular responsables del aumento en la resistencia de salida del acuoso. Dichos cambios son:
MATRIZ EXTRACELULAR: se produce un acúmulo de glucosaminoglicanos (retención de H2O), proteínas (elastina, laminina, fibronectina), colágeno IV y VI, y un aumento en la actividad de los inhibidores de las MMPs acompañado de una disminución en la actividad de las metaloproteinasas (MMPs).
MORFOLOGÍA CELULAR: con aumento del tamaño de las células y del núcleo.
FUNCIÓN CELULAR: Cross-linkage de las fibras de actina o «cross-linked actin networks».
CITOESQUELETO: se produce una inhibición de la proliferación y de la migración con inhibición de la fagocitosis, lo que conlleva a un acúmulo de restos en la malla trabecular.
Aspectos clínicos
En los niños la respuesta es variable (¿variación racial?).
Lo que sí presentan los niños es mayor SENSIBILIDAD a los corticoides, y esto hará que sea más frecuente, más severa y más rápida, y cuanto más joven sea el niño mayor será la sensibilidad al fármaco, sobre todo en edades inferiores a los 10 años, debido a que la malla trabecular presenta una inmadurez funcional, siendo inmaduro al nacimiento alcanzando la madurez entre el primer y el octavo año de vida.
La presentación clínica es similar al GPAA pero con el antecedente del uso de corticoides. La formas de presentación puede ser:
• Asintomático.
• ↑PIO.
• Edema corneal, estrías corneales.
• Buftalmus (uni o bilateral).
• ↑diámetro corneal.
• ↑Longitud axial.
• Ángulo abierto.
• Facies cushingoide.
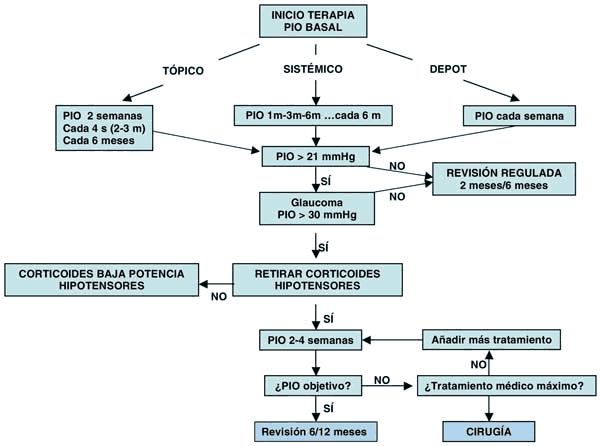
1. Medición de PIO
– PIO BASAL: antes de la administración de cualquier corticoide se aconseja la medición de la PIO. Una vez administrado, y según la vía de administración, se aconseja la revisión de la misma de la siguiente manera:
• TÓPICA:
2 semanas/cada 4 semanas.
(2-3 meses)/cada 6 meses.
• SISTÉMICA:
1 mes/3 meses/6 meses — cada 6 meses.
• INTRAVÍTREA:
Cada semana (puede ser activo 100 días).
2. Indicación de cese del tratamiento
En primer lugar, asegurarse de que los corticoides son los responsables del aumento de PIO. Deberán ser retirados ante la presencia de glaucoma o progresión del mismo y sustituidos por un fármaco que produzca menos aumento de PIO.
• Fluorometolona 0,1% • Rimexolone • AINEs |
} |
Tópico |
• Ciclofosfamida • Metotrexate |
} |
Sistémico |
La normalización de la PIO se obtiene de 2 a 3 días en caso de que la respuesta fuese de manera aguda y de 1 a 4 semanas, incluso de meses a años, en caso de ser una respuesta de tipo crónico.
3. Glaucoma/HTO irreversible
Se desarrolla en el 3% de los casos y suele tratarse de:
• Historia familiar de glaucoma (GPAA enmascarado).
• Uso crónico de corticoides (4 años).
4. Tratamiento antiglaucomatoso
Se administrará en:
• Fase de retirada.
• No podemos retirar los corticoides.
• Glaucoma.
Médico
B-bloqueantes
Análogos de prostaglandinas
α-agonistas
Inhibidores de la AC
Quirúrgico
Nuevas terapias
• MIFEPRISTONE: bloqueante de receptores corticoideos. Se ha usado sólo en animales de experimentación.
• DICLOFENACO + ISV-205: bloquea la inducción de MYOC protein.
• ANECORTAVE:
– Esteroide angiostático.
– Aplicación subtenoniana (1 ml 75 mgr/ml ó 7,5%).
– Produce un ↑ salida de acuoso.
– ↑MMPs (¿?)
• TERAPIA GÉNICA: AdhGRE.MMP1 (Adenovirus portador de una MMP):
– Disminución 70% PIO a las 24 horas/10-13 mmHg en 48 h.
– Preinyección proteje contra ↑ PIO.
Bibliografía
- Corticosteroid-induced glaucoma: a review of the literature. JP Kersey et al. Eye 2006; 20: 407-416.
- Assessment of SNPs associated with the human glucocorticoid receptor in primary open-angle glaucoma and steroid responders. John H. Fingert et al. Molecular Vision 2010; 16: 569-601.
- Morphologic changes in the outflow pathways of bovine eyes treated with corticosteroids. Tektas OY et al. Invest Ophtalmol Vis Sci 2010; 51(8): 4060-6.
- Treatment of sheep steroid-induced ocular hypertension with a glucocorticoid-inducible gene therapy virus. Rosana Gerometta et al. Invest Ophtalmol Vis Sci 2010; 51: 3042-3048.
- Suppresion of corticosteroid-induced ocular hypertension in sheep by Anecortave. Oscar A. Candia et al. Arch Ophtalmol 2010; 128(3): 338-343.