Fisiopatología del ojo seco
Díaz Valle D 1 , Benítez del Castillo JM 1
1 Unidad de Superficie e Inflamación Ocular. Hospital Clínico San Carlos. Madrid.
Introducción
Según la nueva definición propuesta por el Dry Eye Workshop Study Group (DEWS), el Ojo Seco o Síndrome de Disfunción Lagrimal (SDL) puede definirse como una enfermedad de la película lagrimal y de la superficie ocular, de origen multifactorial, que cursa con molestias oculares, fluctuaciones visuales, inestabilidad de la película lagrimal y daño potencial sobre la superficie ocular (1).
La propia definición incluye dos factores fisiopatológicos comunes a todo ojo seco, para destacar así el importante papel que ambos desempeñan: 1) hiperosmolaridad de la película lagrimal y 2) inflamación de la superficie ocular.
Para comprender la delicada homeostasis de la superficie ocular es preciso conocer la llamada Unidad lagrimal funcional (ULF) (fig. 1), que es la responsable, entre otras funciones, de mantener la integridad de la película lagrimal. La ULF está compuesta por: 1) glándulas lagrimales principales y accesorias, 2) la superficie ocular, 3) los párpados, 4) los nervios (sensoriales, motores y autónomos) que los conectan entre sí (arcos nerviosos reflejos). La vía aferente está mediada por el V par o trigémino, mientras que los impulsos eferentes están vehiculizados por el VII par o facial. Puede observarse cómo las terminaciones parasimpáticas del VII par regulan la composición de la lágrima y mantienen un equilibrio adecuado en los componentes acuoso, mucinoso y lipídico. Las terminaciones motoras, por su parte, son responsables de los aspectos hidrodinámicos que permitirán un adecuado aclaramiento, distribución y evaporación de la película lagrimal.
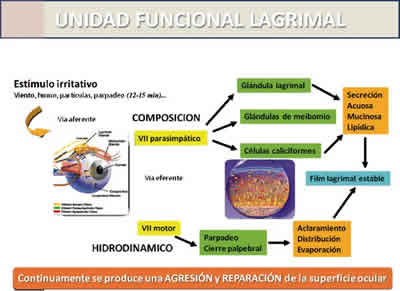
Fig. 1. Conexiones nerviosas responsables de la integraciòn neuroanatómica de la unidad lagrimal funcional. La vía aferente está mediada por la primera rama del V par, mientras que la eferente está vehiculizada por fibras motoras y autónomas del VII par.
Fisiopatología del Síndrome de Ojo Seco (SOS)
En la figura 2 se muestra un esquema fisiopatológico global que resume los mecanismos fisiopatológicos que interactúan en el SOS. El evento patogénico principal del SOS deriva de la hiperosmolaridad y de la inestabilidad de la película lagrimal. La hiperosmolaridad causa una serie de lesiones sobre el epitelio de la superficie ocular mediante la activación de una cascada de eventos inflamatorios y la liberación de una serie de citoquinas proinflamatorias (2). Este daño epitelial incluye básicamente la muerte de las células epiteliales por fenómenos de apoptosis, pérdida de células caliciformes y alteración de la expresión de las mucinas de superficie, lo cual provoca una inestabilidad del film lagrimal, que agrava la hiperosmolaridad, cerrando así el círculo vicioso. Por otra parte, como se muestra en la figura 2, la inestabilidad lagrimal puede iniciarse por otras etiologías, independientemente de la hiperosmolaridad, como son la xeroftalmia, la alergia ocular, la exposición a conservantes o el uso de lentes de contacto.
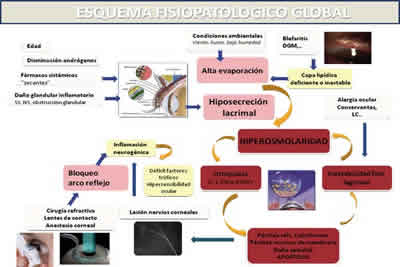
Fig. 2. Esquema fisiopatológico global. Véase explicación en el texto. Adaptado de Lemp M, Badouin C, Baum J, et al. DEWS definition and classification. The Ocular Surface 2007; 5: 75-92.
La lesión epitelial causada por el SOS produce una estimulación de los nervios corneales, lo que justifica los síntomas de escozor y molestias oculares, el aumento del parpadeo y potencialmente un mayor lagrimeo reflejo que refieren los pacientes con sequedad ocular.
Las causas principales de la hiperosmolaridad lagrimal son la reducción del componente acuoso lagrimal por una insuficiencia de la glándula lagrimal y/o un aumento en la evaporación lagrimal, favorecido en general por condiciones ambientales adversas (baja humedad ambiental, aire acondicionado, humo, etc.) (3). El aumento de la evaporación lagrimal también se ve incrementado en los casos de disfunción de las glándulas de meibomio (DGM), que producen una alteración en el componente lipídico del film lagrimal. La reducción del flujo acuoso lagrimal se ha relacionado con la edad (4,5), la disminución en los niveles de andrógenos (6), el efecto de algunos fármacos sistémicos como los antihistamínicos y otros fármacos con acción antimuscarínica sobre la secreción lagrimal, así como con el daño inflamatorio sobre la glándula lagrimal que acontece en el síndrome de Sjögren, que produce una destrucción del tejido glandular (7).
La secreción lagrimal también puede verse comprometida por la cicatrización conjuntival como ocurre en el penfigoide de membranas mucosas (8), o bien en situaciones en las que existe un bloqueo del arco reflejo neuroanatómico (9). Existen varias patologías que pueden causar una hiposecreción lagrimal en relación con la pérdida de la sensibilidad corneal y una reducción en la secreción lagrimal refleja como la cirugía refractiva corneal (LASIK), el uso crónico de las lentes de contacto (10), el abuso de anestésicos o la queratopatía neurotrófica (11).
Bibliografía
- 2007 Report of the International Dry Eye Workshop (DEWS). The Ocular Surface 2007; 5: 65-202.
- Li DQ, Chen Z, Song XJ, et al. Stimulation of matrix metalloproteinases by hyperosmolarity via a JNK pathway in human corneal epithelial cells. Invest Ophthalmol Vis Sci 2004; 45: 4302-11.
- Paschides CA , Stefaniotou M, Papageorgiou J, et al. Ocular surface and environmental changes. Acta Ophthalmol Scand 1998; 876: 74-77.
- Mathers WD, Lane JA, Zimmerman MB. Tear film changes associated with normal aging. Cornea 1996; 15: 229-34.
- Tomlinson A, Geisbrecht J. The aging tear film. Br J Contact Lens Assoc 1993; 16: 67-9.
- Sullivan DA. Androgen deficiency and dry eye syndromes. Arch Soc Esp Oftalmol 2004; 79: 49-50.
- Zoukhri D. Effect of inflammation on lacrimal gland function. Exp Eye Res 2006; 82: 885-98.
- Eschle-Meniconi ME, Ahmad SR, Foster CS. Mucous membrane pemphigoid: an update. Curr Opin Ophthalmol 2005; 16: 303-7.
- Battat L, Macri A, Dursun D, Pflugfelder SC. Effects of laser in situ keratomileusis on tear production, clearance, and the ocular surface. Ophthalmology 2001; 108: 1230-5.
- Gilbard JP, Gray KL, Rossi SR. A proposed mechanism for increased tear-film osmolarity in contact lens wearers. Am J Ophthalmology 1986; 102: 505-7.
- Cavanagh HD, Colley AM. The molecular basis of neurotrophic keratitis. Acta Ophthalmol Suppl 1989; 192: 115-34.