Rentabilidad diagnóstica de los sistemas de análisis de progresión del tomógrafo retiniano de Heidelberg
Dres. Martínez-de-la-Casa JM1, García-Feijoó J1, Vizzeri G2, Bowd C2
1 Hospital Clínico San Carlos. Madrid. Instituto de Investigaciones Oftalmológicas Ramón Castroviejo. Universidad Complutense. Madrid. España.
2 Hamilton Glaucoma Center. Universidad de California San Diego. USA.
Resumen
Objetivo: Evaluar la capacidad para detectar progresión de los sistemas de análisis actualmente disponibles en el tomógrafo retiniano de Heidelberg (HRT).
Métodos: 112 ojos de 112 pacientes con glaucoma o sospecha de glaucoma, con >-2 años de seguimiento y >-4 exploraciones HRT fueron incluidos en el estudio. La existencia de progresión fue definida por la existencia de cambios compatibles con glaucoma en las estereofotografías y/o en las perimetrías realizadas durante el seguimiento. La existencia de progresión con el HRT fue evaluada mediante el Topographic Change Analysis (TCA) y el Trend Analisis (TA). Los criterios utilizados para definir progresión fueron, respectivamente, la existencia de un cluster mayor de 20 superpixels (TCA) y un descenso >-0,05 en el Average Normalized Parameter (TA) en tres exámenes consecutivos.
Resultados: El seguimiento medio fue de 51,7±10,5 meses con una mediana de 4 exploraciones (rango 4-7), observándose que 20 ojos progresaron durante el seguimiento. Encontramos una pobre concordancia entre los resultados del TCA y el TA (K=0,121). Asimismo, se encontró un bajo grado de concordancia entre ambos análisis y los gold estándar (GS) (TCA vs GS: 0,117, TA vs GS: 0,095). Los valores de sensibilidad/especificidad fueron de 35/78% para el TCA y de 10/96% para el TA.
Conclusiones: Existe un bajo grado de concordancia entre los resultados de los sistemas de análisis de progresión del HRT y los GS actualmente aceptados para definir progresión en el curso del glaucoma.
Introducción
Documentar los cambios estructurales y funcionales durante el curso del glaucoma es fundamental para el manejo de los pacientes con glaucoma. Numerosos estudios transversales han demostrado recientemente que los nuevos instrumentos para el análisis de la cabeza del nervio óptico y la capa de fibras nerviosas de la retina pueden detectar el daño estructural y diferenciar entre sujetos normales y pacientes con glaucoma en los diferentes estadíos de la enfermedad (1-5). Por el contrario, hasta el momento, son escasos los estudios longitudinales y prospectivos que evalúen la capacidad de estos nuevos sistemas de análisis para detectar la progresión de la enfermedad (6-10).
El láser confocal de barrido (CSLO), es una de las herramientas más difundidas para el análisis de la topografía de la cabeza del nervio óptico (11-17). A lo largo de los últimos años se han desarrollado distintas herramientas para detectar progresión basadas en el CSLO, si bien éstas aún no han sido evaluadas en cohortes de pacientes independientes.
El objetivo del presente estudio es evaluar la capacidad para detectar progresión de las distintas herramientas de análisis actualmente disponibles en el CSLO, comparándolas con los gold estándar actualmente establecidos y determinar la posible influencia del tiempo de seguimiento o del número de exploraciones realizadas en el resultado de las mismas.
Material y métodos
Los pacientes fueron evaluados de manera prospectiva en el Hamilton Glaucoma Center de la Universidad de California San Diego como parte del Estudio sobre Innovaciones Diagnósticas en Glaucoma (DIGS).
Previamente al inicio del estudio, se obtuvo el consentimiento informado de todos los pacientes incluidos y se logró la aprobación del Comité Ético de la Universidad de California San Diego.
A cada participante se le realizó una exploración oftalmológica completa que incluyendo el registro de posibles antecedentes de interés, agudeza visual mejor corregida (AVMC), exploración del segmento anterior con lámpara de hendidura, tonometría de aplanación con tonómetro de Goldmann, gonioscopia, exploración del fondo de ojo con lente de 78 dioptrías, estereofotografías del nervio óptico (TRC-SS, Topcon Instruments Corp. of America, Paramus, NJ) y perimetría estándar (PAS, Humphrey Field Analyzer II, Carl Zeiss Meditec), utilizando el algoritmo Swedish interactive threshold (SITA) 24-2. Para poder ser incluido en el estudio, los participantes debían tener una AVMC mayor de 20/40, un equivalente esférico menor de 5 dioptrías, un astigmatismo menor de 3 dioptrías y un ángulo iridocorneal abierto. Se permitió la inclusión en el estudio de pacientes con antecedentes familiares de glaucoma, así como pacientes con cirugías previas de cataratas o glaucoma no complicadas.
Se excluyeron del estudio los pacientes con glaucomas secundarios así como aquellos con otras patologías oculares distintas de glaucoma, con patologías no oculares que cursaran con afectación del campo visual (ej. patologías hipofisarias, desmielinizantes, VIH o SIDA,…), o con medicaciones sistémicas que pudiesen interferir con la exploración del campo visual o con la visión de los colores.
Para ser incluidos en el presente estudio, se requirió que los pacientes tuvieran un seguimiento igual o superior a 4 años, con al menos 4 exploraciones CSLO y con campos visuales fiables (falsos positivos y pérdidas de fijación < 25%, falsos negativos < 33%) y estereofotografías realizadas con menos de 3 meses de separación con respecto a las exploraciones CSLO.
Oftalmoscopio Confocal de Barrido
Para la adquisición de las imágenes CSLO se utilizó el Tomógrafo Retiniano de Heidelberg II (HRT, Heidelberg Engineering GMBH, Dossenheim, Germany, v 3.0). El HRT permite obtener imágenes tridimensionales de la cabeza del nervio óptico (18). En cada exploración se obtuvieron tres imágenes consecutivas que el software del aparato se encarga de alinear. La imagen promedio fue la utilizada para el análisis. Los errores de magnificación fueron corregidos utilizando la queratometría del ojo estudiado. Un observador experimentado se encargo de delinear el contorno del nervio óptico utilizando como referencia las estereofotografías papilares. Todas las imágenes incluidas en el estudio fueron revisadas para asegurar un correcto centrado, enfoque e iluminación desechándose las imágenes de mala calidad. Todas las imágenes incluidas en el análisis tuvieron una desviación estándar < de 50 µm, cumpliendo de esa manera con las recomendaciones de calidad dictadas por los fabricantes del HRT.
Para el presente estudio, tres observadores independientes analizaron la totalidad de las imágenes y evaluaron la existencia de progresión, utilizando para ello los dos programas de análisis actualmente disponibles en el HRT: el Topographic Change Analysis (TCA) y el Trend Analysis (TA). La identidad de los pacientes incluidos fue enmascarada, de tal manera que los examinadores desconocían, a la hora de evaluar la progresión, la historia clínica de los pacientes, la gradación de las estereofotografías y el estado del campo visual. Los desacuerdos entre los observadores fueron resueltos por consenso (2 de 3).
Ambos programas fueron evaluados también utilizando los criterios objetivos aceptados actualmente para definir progresión. Estos criterios serán expuestos detalladamente más adelante.
Métodos de análisis
Topographic Change Analysis (análisis de eventos): para el análisis objetivo se consideró como progresión la presencia de un cluster (agrupación de pixels) con una extensión mayor de 20 superpixels (1 superpixel = 16 pixeles) en tres visitas consecutivas con una probabilidad de error menor del 5% (6,19) (TCA20). Para el cálculo del tamaño del cluster se desarrolló un programa en MATLAB (The Mathworks, Inc., Natick, MA). El análisis subjetivo (TCAs) fue realizado por los tres observadores atendiendo al tamaño, la localización, la altura y la reproducibilidad de los cambios observados.
Trend Analysis (análisis de tendencias): se utilizó para el análisis el informe de progresión del Parámetro Medio Normalizado. Para cada paciente, el informe fue evaluado para tres diferentes combinaciones de sectores:
G, TS, TI (TATSTI): global, temporal superior (45º to 90º) y temporal inferior (-90º to -45º).
G, S, I (TASI): global, cuadrante superior (22.5º to 112.5º) y cuadrante inferior (-112.5º to -22.5º).
G, U, L (TUL): global, hemisferio superior (0º to 180º) y hemisferio inferior (-180º to 0º).
El criterio utilizado para establecer progresión fue un descenso mayor de 0,05 en tres visitas consecutivas (19). El análisis subjetivo (TAs) de las tendencias fue realizado por cada uno de los tres observadores de forma independiente.
Campimetría
El examen del campo visual fue realizado al menos una vez al año durante el seguimiento, utilizando el algoritmo SITA 24-2. (Humphrey Visual Analyzer, Carl Zeiss Meditec). La progression fue evaluada utilizando el Glaucoma Progression Analysis (GPA). El GPA define la existencia de progresión cuando tres estímulos muestran una reducción significativa de la sensibilidad (p<0,05) en tres exámenes consecutivos (20).
Estereofotografías
Durante el seguimiento, se tomaron estereofotografías al menos una vez al año (TRC-SS; Topcon Instrument Corp of America, Paramus, New Jersey, USA). Las fotografías basales fueron tomadas el mismo día del HRT basal en más del 50% de los pacientes incluidos. Aquellos pacientes con más de tres meses de diferencia entre las fotografias y el HRT fueron excluidos del análisis. Cada fotografía fue gradada como glaucomatosa o normal basándose en la presencia o ausencia de un adelgazamiento del anillo neuroretiniano o de la capa de fibras nerviosas de la retina (focal o difuso), excavación papilar compatible con glaucoma o asimetría mayor a 0,2.
Para maximizar la posibilidad de detectar progresión, la primera y la última fotografía de cada paciente fueron evaluadas por dos observadores experimentados. Los desacuerdos fueron resueltos por consenso. Los observadores evaluaron las fotografías desconociendo la historia clínica y evolución de cada paciente.
Análisis estadístico
El análisis estadístico fue realizado utilizando el SPSS (version 12.0; SPSS Inc., Chicago, IL) y el MedCalc (version 8.0.1.0 MedCalc Software, Belgium).
El test de Kolmogorov-Smirnov fue utilizado para comprobar la normalidad de las variables cuantitativas evaluadas. Estas fueron expresadas mediante las correspondientes medias y desviación estándar (DE). La mediana y el rango intercuartil se utilizó para describir las variables con distribución no normal.
Los resultados obtenidos con cada uno de los sistemas evaluados fue comparado con la existencia de progresión basados en los gold estándar (estereofotografías y campo visual). Para cada uno de los análisis evaluados se calculó la sensibilidad y la especificidad.
El índice Kappa fue utilizado para determinar el grado de concordancia entre los diferentes test evaluados: valores k menores de 0,20 fueron considerados como mala concordancia; entre 0,21 y 0,40 regular; entre 0,41 y 0,60 moderada; entre 0,61 y 0,80 buena y entre 0,81 y 1,00 muy buena.
Resultados
112 ojos de 112 pacientes cumplieron los criterios de inclusión/exclusión y fueron incluidos en el análisis. De los 112 ojos, 88 fueron considerados como glaucomatosos (campimetría anormal con PSD>5% y/o test de hemicampo para glaucoma anormal) y 24 fueron considerados como sospechosos (nervio óptico compatible con glaucoma y campo visual normal o nervio óptico normal con presión intraocular (PIO) consistentemente por encima de > 22 mmHg). La edad media de los pacientes incluidos fue de 67,9 (11,2) años (DE), 62 (55,3%) fueron mujeres y 101 (90,2%) caucásicos. La desviación media (MD) del campo visual fue de -1,5 dB (rango -13,7 a 3,7 dB) y la desviación media del patrón (PSD) fue de 2,5 dB (rango 1,0 a 12,5 dB). El tiempo medio de seguimiento fue de 51,7 (10,5) meses, con una mediana de 4 exploraciones HRT (rango 4-7).
20 de los 112 (17,8%) ojos progresaron durante el seguimiento. En 13 de ellos la progresión fue documentada mediante estereofotografías y en 6 a través del campo visual. Unicamente en un ojo coincidieron las fotografías y el campo visual en señalar la existencia de progresión.
La tabla I muestra el grado de concordancia (K) entre los diferentes métodos de análisis. La concordancia fue generalmente mala al comparar los resultados del TCA con los del TA.
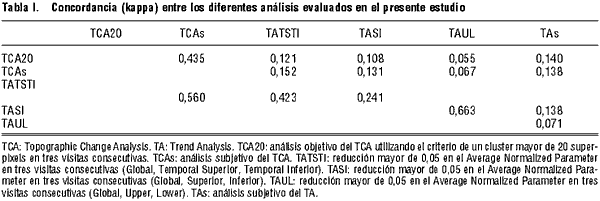
Al comparar entre si los diferentes tipos de análisis del TCA encontramos un moderado grado de concordancia. Los diferentes tipos de análisis del TA mostraron entre si una concordancia entre moderada y buena (0,423 to 0,663), por lo que, para simplificar las comparaciones se utilizó el TATSTI como TA objetivo (TA).
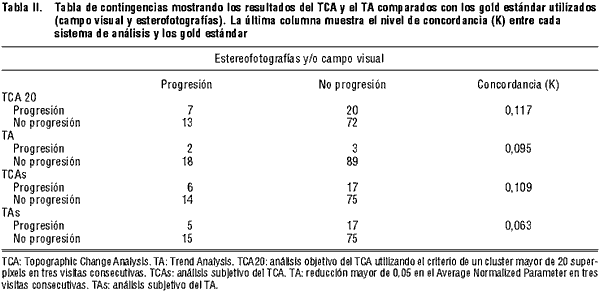
Posteriormente, la muestra fue dividida en tres grupos en función del número de exploraciones realizadas durante el seguimiento. En la tabla III se muestra el número de ojos en cada grupo, el seguimiento medio y el número de ojos que progresaron en cada grupo según las stereofotografías y/o el campo visual.

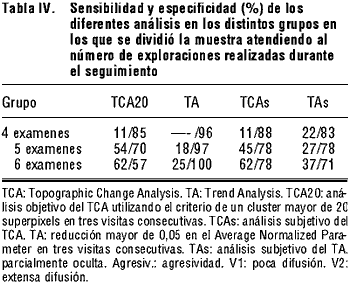
El aumento en el número de exploraciones y en el tiempo de seguimiento se tradujo en un significativo incremento en la sensibilidad del TCA20, pasando de un 11% en el grupo de 4 exploraciones a un 62% en el grupo de >-6 exploraciones. Los resultados obtenidos con el análisis subjetivo del TCA fueron similares, incrementándose la sensibilidad desde un 11% en el grupo de 4 exploraciones hasta un 62% en el grupo de >-6 exploraciones (tabla IV). Para el TA y el TAs, los niveles de sensibilidad fueron bajos en los tres grupos evaluados (oscilando entre el 18% y el 37%). Por el contrario, los niveles de especificidad fueron significativamente mayores que en el caso del TCA. La aplicación de los criterios actualmente sugeridos para este tipo de análisis ofreció valores más altos de especificidad (entre 96% y 100%) que la evaluación subjetiva del mismo (entre 71 y 83%) (tabla III).
Discusión
La comparación de cualquier test diagnóstico con un gold estándar presenta la limitación de que la rentabilidad diagnóstica del test evaluado siempre será inferior a la del referente con el que es comparado. Con esta limitación, el diseño de este estudio permite analizar y comparar el funcionamiento de las dos herramientas de análisis de progresión actualmente disponibles en el HRT. Con el presente estudio hemos demostrado que estos test son dependientes del tiempo de seguimiento y del número de exploraciones realizadas durante el mismo.
El TCA ha sido específicamente diseñado para detectar progresión. Chauhan et al (6) inicialmente establecieron como criterio para definir progresión la existencia de un cluster con una extensión mayor de 20 superpíxeles en tres exploraciones consecutivas. Aunque éste es el criterio actualmente aceptado e incorporado al software del aparato, otros muchos criterios han sido sugeridos para definir progresión en los distintos estadíos de la enfermedad, sin que hasta el momento exista un consenso total acerca de que criterio utilizar. El desarrollo de estos nuevos criterios viene motivado por la necesidad de ajustar el tamaño del cluster que defina la progresión al tamaño del nervio óptico. Utilizar el mismo tamaño de cluster independientemente del tamaño del nervio óptico podría ocasionar que el cambio requerido fuese relativamente mucho mayor en nervios ópticos de pequeño tamaño. Del mismo modo, la utilización del criterio de los 20 superpíxeles podría implicar que la progresión pudiese pasar desapercibida en nervios con grandes excavaciones y anillos neuroretinianos de pequeño tamaño, así como en nervios ópticos con un daño avanzado y una escasa reserva anatómica.
Por este motivo, los nuevos criterios están basados tanto en el tamaño relativo del cluster con respecto al tamaño total del disco (oscilando entre el 0,1% y el 2%) como en la profundidad del cambio (entre 0 y 50 micras) (21,22).
En el presente estudio se introdujo la evaluación subjetiva del TCA por dos motivos: el primero es que en la actualidad no existe una herramienta en el software del HRT que permita contabilizar el número de superpixels presente en un determinado cluster, dificultando al examinador determinar si alguno supera los 20 superpíxeles que definen la existencia de progresión. El otro motivo por el que se introduja el análisis subjetivo fue permitir a los tres exploradores que evaluaban las imágenes determinar la existencia de progresión en ojos que presentaran clusters menores de 20 superpíxeles pero que pudieran resultar clínicamente significativos (por ejemplo, aquellos situados en los polos superior e inferior de la excavación) (fig. 1). Los resultados de ambos análisis (objetivo y subjetivo) ofrecieron resultados similares en cuanto a sensibilidad y especificidad. En base a esto, podemos concluir que un observador experimentado puede establecer la existencia de progresión con el TCA sin tener que contabilizar con exactitud el número de superpixels presentes en cada cluster. Por otra parte, la búsqueda de cluster clínicamente significativos con una extensión menor de 20 superpíxeles no incremento la rentabilidad diagnóstica del TCA.
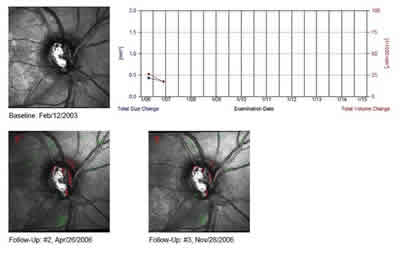
Fig. 1. Topographic Change Analysis realizado en un ojo que progresó durante el seguimiento. La imagen del TAC muestra cambios clínicamente significativos en los polos superior e inferior de la excavación sin que ninguno de los cluster alcance el tamaño requerido de los 20 superpixels. Puede observarse el aumento en el tamaño del defecto en sector inferior en la capa de fibras nerviosas de la retina.
En todos los casos, el grado de concordancia entre los resultados del TCA y los gold estándar fue bajo (–0,057 a 0,336), siendo generalmente mejor al incrementar el número de exploraciones y el tiempo de seguimiento. Esta disociación entre los resultados del TCA y las estereofotografías/campo visual ha sido ya previamente descrita y se ha propuesto que los criterios utilizados para definir progresión en el campo visual o la existencia de posibles errores a la hora de gradar las estreofotografías podrían limitar la concordancia con los resultados del TCA.
En nuestro grupo de 15 pacientes con 6 o más exploraciones, 9 (60%) fueron clasificados correctamente por el TCA20. De los 6 restantes, 3 ojos (20%) clasificados como progresión no fueron detectados por el TCA20, mientras que los 3 restantes (20%) que fueron clasificados como progresión por el TCA20 no mostraron cambios en el campo visual ni en las estereofotografías.
Hasta el momento son muy escasos los estudios longitudinales que evalúen estas nuevas herramientas para el análisis de la progresión en el glaucoma. Chauhan et al (6), en un estudio prospectivo longitudinal con un seguimiento medio de 5,5 años, encontraron una pobre concordancia entre el TCA y los campos visuales a la hora de establecer la existencia de progresión. Los autores concluyeron que esta mala concordancia podría estar motivada por que el TCA fuera más sensible a la hora detectar la existencia de progresión que la perimetría automatizada convencional. Un posterior estudio de los mismos autores encontró resultados similares a la hora de establecer la concordancia entre el TCA y la perimetría convencional7. Patterson et al (8), compararon el TCA20 con un nuevo sistema de análisis de progresión basado en las imágenes del HRT denominado Statistic Image Mapping (SIM). En este estudio, la sensibilidad del TCA para detectar progresión fue del 53%, similar a la encontrada por nosotros en el grupo de pacientes con 5 o más exploraciones a lo largo del seguimiento.
Al contrario que el TCA, el TA ha mostrado bajos niveles de sensibilidad, tanto en el global de los pacientes estudiados como en cada uno de los grupos en los que se dividió la muestra función de las exploraciones realizadas. Este tipo de análisis, ampliamente utilizado en perimetría, se ha demostrado altamente dependiente del número de observaciones realizadas durante el seguimiento, recomendándose un mínimo de 7-8 exploraciones para obtener una adecuada rentabilidad diagnóstica (23,24). Con el criterio utilizado en el presente estudio, el TA ha mostrado niveles de especificidad por encima del 90%, incluso en el grupo con sólo 4 exploraciones.
Al igual que en el caso del TCA, la evaluación subjetiva del TA no aportó ninguna ventaja adicional a la aplicación estricta de los criterios actualmente sugeridos por el fabricante del instrumento.
En resumen, el presente estudio muestra que existe una pobre concordancia entre los dos métodos de análisis de progresión actualmente disponibles en el software del HRT. El TCA presenta unos moderados niveles de sensibilidad cuando se utilizan las estereofotografías y el campo visual como gold estándard para definir la existencia de progresión. La sensibilidad del TCA parece incrementarse a medida que aumentan el número de exploraciones y el tiempo de seguimiento. Por el contrario, el TA ofrece elevados niveles de especificidad, incluso con un limitado número de exploraciones. La combinación de ambos sistemas de análisis, utilizando el TCA como herramienta de screening y el TA como confirmación en los casos positivos para TCA, podría aumentar la rentabilidad diagnóstica de los sistemas de análisis de progresión actualmente disponibles en el HRT.
Bibliografía
- Zangwill LM, Bowd C, Berry CC, Williams J, Blumenthal EZ, Sanchez-Galeana CA, Vasile C, Weinreb RN. Discriminating between normal and glaucomatous eyes using the Heidelberg Retina Tomograph, GDx Nerve Fiber Analyzer, and Optical Coherence Tomograph. Arch Ophthalmol 2001; 119: 985-993.
- Sanchez-Galeana C, Bowd C, Blumenthal EZ, Gokhale PA, Zangwill LM, Weinreb RN. Using optical imaging summary data to detect glaucoma. Ophthalmology 2001; 108: 1812-8181.
- Medeiros FA, Zangwill LM, Bowd C, Sample PA, Weinreb RN. Influence of disease severity and optic disc size on the diagnostic performance of imaging instruments in glaucoma. Invest Ophthalmol Vis Sci 2006 Mar; 47: 1008-1015.
- Bowd C, Zangwill LM, Medeiros FA, Tavares IM, Hoffmann EM, Bourne RR, Sample PA, Weinreb RN. Structure-function relationships using confocal scanning laser ophthalmoscopy, optical coherence tomography, and scanning laser polarimetry. Invest Ophthalmol Vis Sci 2006 Jul; 47: 2889-2895.
- Pueyo V, Polo V, Larrosa JM, Ferreras A, Pablo LE, Honrubia FM. Diagnostic ability of the Heidelberg retina tomograph, optical coherence tomograph, and scanning laser polarimeter in open-angle glaucoma. J Glaucoma 2007; 16: 173-177.
- Chauhan BC, McCormick TA, Nicolela MT, et al. Optic disc and visual field changes in a prospective longitudinal study of patients with glaucoma. Arch Ophthalmol 2001; 119: 1492-1499.
- Artes PH, Chauhan BC. Longitudinal changes in the visual field and optic disc in glaucoma. Prog Retin Eye Res 2005; 24: 333-354.
- Patterson AJ, Garway-Heath DF, Strouthidis NG, Crabb DP. A new statistical approach for quantifying change in series of retinal and optic nerve head topography images. Invest Ophthalmol Vis Sci 2005; 46: 1659-1667.
- Kalaboukhova L, Fridhammar V, Lindblom B. Glaucoma follow-up by the Heidelberg retina tomograph—new graphical analysis of optic disc topography changes. Graefes Arch Clin Exp Ophthalmol 2006; 244: 654-662.
- Kourkoutas D, Buys YM, Flanagan JG, Hatch WV, Balian C, Trope GE. Comparison of glaucoma progression evaluated with Heidelberg retina tomograph II versus optic nerve head stereophotographs. Can J Ophthalmol 2007; 42: 82-88.
- Mikelberg FS, Parfitt CM, Swindale NV, et al. Ability of the Heidelberg Retina Tomograph to detect early glaucomatous field loss. J Glaucoma 1995; 4: 242-247.
- Zangwill LM, van Horn S, De Souza Lima M, et al. Optic nerve head topography in ocular hypertensive eyes using confocal scanning laser ophthalmoscopy. Am J Ophthalmol 1996; 122: 520-525.
- Uchida H, Brigatti L, Caprioli J. Detection of structural damage from glaucoma with confocal laser image analysis. Invest Ophthalmol Vis Sci 1996; 37: 2393-2401.
- Hatch WV, Flanagan JG, Etchells EE, et al. Laser scanning tomography of the optic nerve head in ocular hypertension and glaucoma. Br J Ophthalmol 1997; 81: 871-876.
- Wollstein G, Garway-Heath D, Hitchings R. Identification of early glaucoma cases with the scanning laser ophthalmoscope. Ophthalmology 1998; 105: 1557-1563.
- Cioffi GA, Robin AL, Eastman RD, et al. Confocal laser scanning ophthalmoscope. Reproducibility of optic nerve head topographic measurements with the confocal laser scanning ophthalmoscope. Ophthalmology 1993; 100: 57-62.
- Rohrschneider K, Burk ROW, Kruse FE, et al. Reproducibility of the optic nerve head topography with a new laser tomographic scanning device. Ophthalmology 1994; 101: 1044-1045.
- Weinreb RN. Laser scanning tomography to diagnose and monitor glaucoma. Curr Opin Ophthalmol 1993; 4: 3-6.
- How to interpret progression HRTII. HRT manual. Heidelberg Engineering GmbH. Dossenheim. Germany.
- Leske MC, Heijl A, Hyman L, Bengtsson B. Early Manifest Glaucoma Trial: design and baseline data. Ophthalmology 1999; 106: 2144-2153.
- Artes PH, Chauhan BC. Criteria for Optic Disc Progression with the topograhical change análisis of the Heidelberg Retina Tomograph. Invest Ophthalmol Vis Sci 2006; S4349.
- Chauhan BC, Lavender SA, Macgillivray CA, Artes PH, Nicolela MT. Optic Disc Changes in Ocular Hypertension. Results From a Longitudinal Prospective Study With Scanning Laser Tomography. Invest Ophthalmo Vis Sci 2007; S3330.
- Katz J, Gilbert D, Quigley HA, Sommer A. Estimating progression of visual field loss in glaucoma. Ophthalmology 1997; 104: 1017-1025.
- Spry PG, Bates AB, Johnson CA, Chauhan BC. Simulation of longitudinal threshold visual field data. Invest Ophthalmol Vis Sci 2000; 41: 2192-2200.