Indicaciones actuales de la angiografía fluoresceínica
Dres. S. Figueroa M1, Lara Medina J2
1 Departamento de Retina y Vítreo. Servicio de Oftalmología. Hospital Ramón y Cajal. Madrid. Vissum Madrid.
2 Departamento de Retina y Vítreo. Servicio de Oftalmología. Hospital Ramón y Cajal. Madrid.
La angiografía fluoresceínica (AFG) es un método diagnóstico que permite el estudio de la circulación de la retina y la coroides. Fotografías de la retina son tomadas después de la inyección intravenosa de fluoresceína sódica.
En los últimos años han surgido nuevas técnicas para el estudio de las enfermedades retinianas, entre las que destaca la tomografía de coherencia óptica (OCT). Esto ha producido un cambio en las indicaciones para la realización de angiografías, reduciendo el espectro de situaciones en el que se solicita la prueba.
En el siguiente artículo se repasan las actuales indicaciones de la AFG en nuestro medio para las principales patologías retinianas.
Degeneración macular asociada a la edad (DMAE)
En los países desarrollados, la DMAE es la principal causa de pérdida severa de visión central en uno o ambos ojos en personas mayores de 50 años.Una de las principales indicaciones de la AFG actualmente es el estudio de esta enfermedad, permitiendo tanto el diagnóstico como la clasificación de la misma para, posteriormente, plantear las distintas estrategias terapéuticas.
Los patrones fluoresceínicos en la DMAE son variados y pueden clasificarse en lesiones hiperfluorescentes e hipofluorescentes.
| Hiperfluorescentes: | Hipofluorescentes: |
| Drusas duras y blandas | Hemorragias retinianas |
| Atrofia EPR | Lípidos |
| Rotura EPR | Proliferación pigmentaria |
| Membrana neovascular | |
| Desprendimiento seroso del EPR | |
| Fibrosis subretiniana | |
| Cicatrices de láser |
El principal motivo para realizar una AFG en la DMAE tipo atrófica es permitir la confirmación diagnóstica, excluyendo básicamente la presencia de una membrana neovascular (1).
En el caso de la DMAE tipo exudativa (2), la AFG se utiliza fundamentalmente para definir la estrategia terapéutica, basándonos en tres variables: localización, tipo de la lesión, tamaño.
La primera variable a estudiar con la AFG en las membranas neovasculares es la localización de la lesión (2). La lesiones se clasifican según su localización en extrafoveales [si el límite de la lesión más próximo a la fóvea está situado a Ž200 µm del centro de la zona avascular de la fóvea (ZAF)], yuxtafoveales (límite de la lesión entre 1 y 200 µm del centro de la ZAF) y subfoveales (situadas debajo del centro de la fóvea).
Los patrones angiográficos de la DMAE exudativa pueden ser complejos, ya que las lesiones pueden estar constituidas por varios componentes: clásico, oculto, hemorragias y desprendimientos serosos.
Los dos principales patrones de las membranas neovasculares son las lesiones clásicas y ocultas. Las lesiones clásicas son áreas hiperfluorescentes, bien definidas, identificadas en las fases iniciales del angiograma, que progresivamente intensifican su fluorescencia en fases tardías.
Las lesiones ocultas (2) pueden ser de dos tipos:
- Desprendimientos fibrovasculares del epitelio pigmentario.
- Hiperfluorescencia tardía de origen indeterminado.
Los desprendimientos fibrovasculares del EPR consisten en un elevación irregular del EPR que se muestra como una hiperfluorescencia irregular en las fases iniciales del angiograma (normalmente en el primer y segundo minuto tras la inyección). A medida que el estudio progresa, hay una fuga progresiva desde esas regiones hacia zonas adyacentes adquiriendo la zona un patrón punteado de hiperfluorescencia. A diferencia de este tipo de desprendimiento, el desprendimiento seroso del EPR es de superficie lisa y muestra una hiperfluorescencia más homogénea y rápida. La hiperfluorescencia tardía de origen indeterminado se caracteriza por la fuga de colorante en fases tardías del angiograma.
Los términos predominantemente clásica, mínimamente clásica y oculta sin componente clásico es necesario conocerlos para entender las indicaciones y los beneficios de la terapia fotodinámica (2). Las lesiones predominantemente clásicas (fig. 1) son las lesiones donde la membrana clásica ocupa más del 50% de la lesión. Las membranas neovasculares mínimamente clásicas (fig. 2) son aquellas en las que la proporción del componente clásico ocupa entre el 1% y el 49% de la lesión completa. Finalmente, las membranas ocultas sin componente clásico (fig. 3) son aquellas que están constituidas, en su totalidad, por lesiones ocultas.
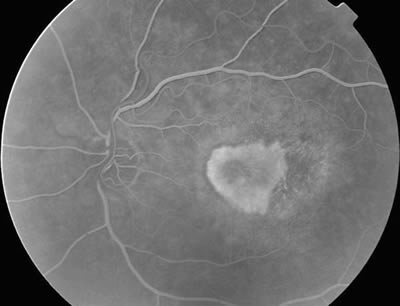
Fig. 1. Membrana neovascular tipo clásica.
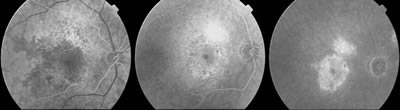
Fig. 2. Membrana neovascular mínimamente clásica.
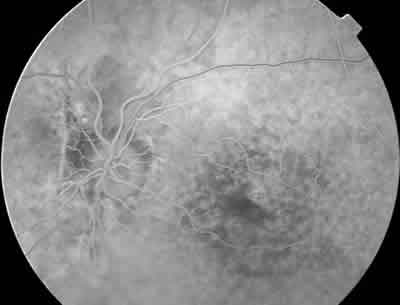
Fig. 3. Membrana neovascular oculta sin componente clásico.
La distinción entre lesiones clásicas y ocultas es importante ya que influye en la decisión terapéutica, variando el tratamiento del paciente en función del tipo de lesión que presente. El tratamiento mediante láser sólo ha mostrado beneficios para las lesiones con componente clásico, y la terapia fotodinámica sólo para las lesiones predominantemente clásicas u ocultas puras, aunque recientemente se ha visto eficacia en las lesiones mínimamente clásicas de pequeño tamaño pequeño o agudeza visual inferior a 0,4.
El tamaño de la lesión es otro parámetro esencial en el tratamiento de las membranas neovasculares coroideas (2). Cuando se determina el tamaño de una lesión neovascular coroidea, el examinador debe incluir todas las áreas de membranas clásicas y ocultas, así como todas las áreas adyacentes de sangre, pigmento o cicatriz. La importancia del tamaño de la lesión queda patente en las membranas mínimamente clásicas en las que se indica tratamiento con TFD sólo si el tamaño es inferior a 4 áreas de disco, 3,5 mm de diámetro máximo o 9,95 mm 2 de área (3).
Además de condicionar el tratamiento a aplicar en la DMAE exudativa, la AFG sirve para valorar la eficacia del tratamiento aplicado y la necesidad de retratamiento. La realización de AFG en los controles periódicos tras el tratamiento sirve para determinar si las lesiones continúan exudando y, por lo tanto, se necesita un nuevo tratamiento, o bien, si simplemente hay una tinción de la lesión, que no implicará nuevas acciones terapéuticas (fig. 4).
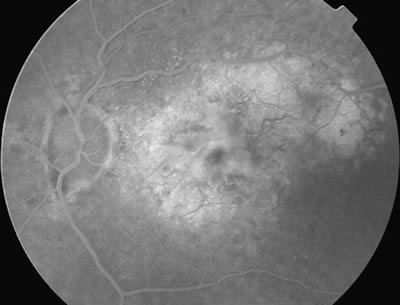
Fig. 4. Tinción de membrana neovascular a los 2 meses de tratamiento con terapia fotodinámica.
Retinopatía diabética
La retinopatía diabética es una de las principales causas de pérdida de visión en pacientes con edades comprendidas entre los 20-64 años. En estos pacientes, el desarrollo de un edema macular constituye, en la mayor parte de los casos, el origen de su baja visión (4). En el estudio oftalmológico de los pacientes diabéticos, la mejor forma de realizar el diagnóstico del edema macular es mediante biomicroscopía de polo posterior. La AGF es útil en demostrar la rotura de la barrera hematorretiniana, poniéndose de manifiesto la existencia de fuga en los capilares retinianos. Sin embargo, la angiografía no debe ser la única herramienta a utilizar para valorar la presencia del edema macular, sino que debe ser la exploración biomicroscópica la base de su diagnóstico. Además, la observación de fuga del contraste en el angiograma no siempre se asocia a engrosamiento en el área macular. Otras pruebas diagnósticas hoy en día disponibles como la tomografía de coherencia óptica permiten identificar, con más precisión que la AGF, la presencia o no de engrosamiento macular y sobre todo, permiten hacer una valoración cuantitativa del grosor retiniano lo cual es realmente útil para evaluar la respuesta al tratamiento. No obstante, la angiografía con fluoresceína sigue siendo una herramienta útil en la diagnóstico y seguimiento del edema macular diabético.
El edema macular diabético puede manifestarse como un engrosamiento focal o difuso de la retina con o sin exudados, encontrándose frecuentemente un solapamiento de ambos tipos (5).
El edema macular focal (fig. 5) se caracteriza por áreas localizadas de fuga de fluoresceína desde lesiones capilares concretas. Este tipo de edema se asocia con la presencia de exudados duros de disposición circinada alrededor de los microaneurismas; esta distribución permite, en la mayor parte de los casos, localizar los microaneurismas responsables del edema macular sin necesidad de AGF (5).
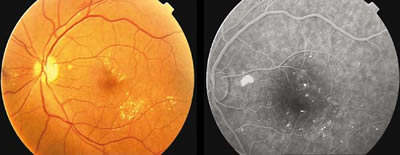
Fig. 5. Edema macular focal: retinografía y angiografía fluoresceínica.
El edema macular difuso (fig. 6) se caracteriza por la aparición de numerosas anomalías capilares retinianas asociadas a una rotura de la barrera hematorretinana externa. En ocasiones adquiere un patrón quístico. En estos casos, la AGF muestra una fuga difusa del contraste en toda la zona macular asociada a múltiples anormalidades vasculares, no pudiéndose establecer un punto concreto responsable del edema (5).
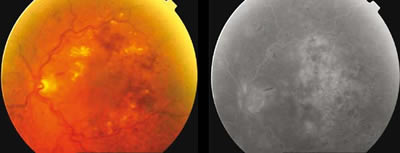
Fig. 6. Edema macular difuso: retinografía y angiografía fluoresceínica.
Enfermedad venosa oclusiva
El pronóstico visual en las oclusiones venosas de la retina se encuentra muy relacionado con la extensión del daño capilar perifoveal y con el grado de isquemia retiniana (6). La AGF se utiliza comúnmente para localizar y cuantificar la extensión de las zonas retinianas no perfundidas. Es importante valorar la integridad de los capilares perifoveales ya que es uno de los principales factores pronósticos para la recuperación visual del paciente. Los principales objetivos de la angiografía en los procesos oclusivos venosos son permitir clasificar las oclusiones en isquémicas y no isquémicas, y determinar la existencia de edema macular (7) (fig. 7).
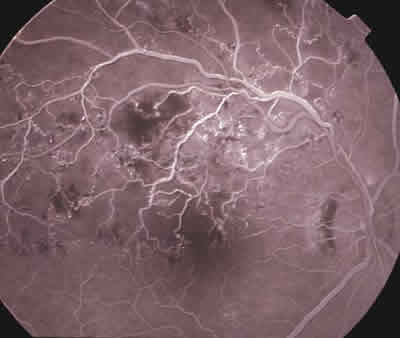
Fig. 7. AFG de paciente con oclusión de rama venosa temporal superior.
La exploración angiográfica en un caso de oclusión venosa retiniana no debe limitarse al polo posterior sino que debe incluir las zonas periféricas ya que en ellas se pueden localizar amplias zonas de isquemia que de otro modo, pasarían inadvertidas.
Debido a la existencia de extensas hemorragias en los estadios iniciales de los procesos oclusivos, la realización de angiografías precoces puede carecer de valor pronóstico al ejercer la sangre un efecto pantalla sobre el lecho capilar retiniano. La prueba debe realizarse en un momento en el que las hemorragias hayan desaparecido prácticamente en su totalidad para permitir el estudio de la retina. Hasta un tercio de las AGF realizadas precozmente en pacientes con oclusión venosa central son interpretadas de forma incorrecta debido a las opacidades de medios o las hemorragias (8).
Otras indicaciones
Coroidopatía central serosa
La coroidopatía central serosa (CCS) se caracteriza por un desprendimiento seroso de la retina sensorial (neuroepitelio) bien circunscrito, producto de una alteración en las funciones de barrera y bomba del EPR, aunque se postula que la alteración inicial puede ser a nivel de la coriocapilar.
Tres patrones angiográficos característicos se pueden observar en la CCS:
- Patrón en mancha de tinta.
- Patrón en humo de chimenea.
- Patrón difuso.
El patrón de punto en mancha de tinta es la forma más frecuente de presentación (fig. 8). El punto representa una pequeña fuga hiperfluorescente procedente de la coroides a través del EPR, apareciendo en fases iniciales del angiograma. Este punto de fuga va incrementando su tamaño e intensidad a medida que progresa la prueba. En las zonas de desprendimiento seroso, el contraste de fluoresceína va rellenando lentamente los espacios a lo largo de la angiografía. En ocasiones, es necesaria la espera hasta tiempos tardíos de 10-15 minutos para localizar fugas lentas o para determinar la verdadera extensión de los desprendimiento subretinianos. En algunos pacientes, pueden coexistir múltiples puntos de fuga. Si no se localiza ningún punto de fuga en la zona macular, debe de explorarse el espacio extramacular, especialmente la zona superior.
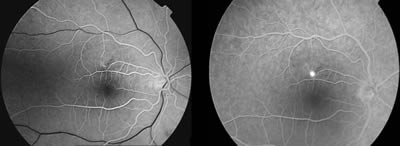
Fig. 8. Patrón de punto de fuga en mancha de tinta en paciente con coroidopatía central serosa. Se puede observar como aumenta la hiperfluorescencia del punto de fuga a lo largo de la prueba.
Ocasionalmente, la fuga de fluoresceína dentro de los espacios subretinianos reproduce un patrón característico llamado patrón en humo de chimenea. La prueba comienza con la presencia de un punto de hiperfluorescencia que se extiende vertical y después lateralmente, dibujando una figura que recuerda la columna de humo de una chimenea. Este patrón característico, se piensa que es el producto de las corrientes de convención y el gradiente de presión existente entre la concentración de proteínas del fluido subretiniano y el contraste de fluoresceína que penetra a través de la fuga. Este patrón aparece aproximadamente en el 10% de los casos de CCS.
En raras ocasiones (9), un desprendimiento seroso extenso, incluso dependiente de la gravedad, puede desarrollarse desde uno o más puntos de fuga externos al polo posterior. Esta situación produce un patrón difuso en la angiografía, sin encontrar a veces un claro punto de fuga. Los pacientes con este patrón pueden presentar grandes áreas de desprendimiento seroso de la retina acompañadas de cambios del EPR. De este modo, la CCS debe formar parte del diagnóstico diferencial de los desprendimientos de retina no regmatógenos.
La existencia de un punto de fuga no debe considerarse la única razón responsable del acúmulo de fluido subretiniano. Aunque una fuga es necesaria para permitir la entrada de fluido, este líquido debería ser eliminado rápidamente del espacio subretiniano por el complejo EPR-coriocapilar. En los casos de central serosa, el fluido continúa acumulándose ya que el defecto principal en esta enfermedad parece ser una alteración difusa del complejo EPR-coriocapilar, que dificulta la eliminación de dicho fluido. De esta forma es posible encontrar formas de desprendimiento seroso del EPR sin asociar elevación de la retina neurosensorial.
Recientemente se ha empezado a utilizar de forma rutinaria la OCT para el diagnóstico y seguimiento de la central serosa; dicha prueba permite cuantificar el acúmulo de fluido localizado debajo de la retina sensorial y del EPR, incluso en casos donde la angiografía y la exploración clínica son incapaces de demostrar la existencia de zonas patológicas.
Síndrome de Irvine-Gass
El término de síndrome de Irvine-Gass es utilizado para denominar al edema macular cistoide que aparece tras cirugía de cataratas. El pico de incidencia aparece entre las seis y diez semanas tras la cirugía, con una resolución espontánea en el 95% de los casos dentro de los primeros seis meses. La mayoría de los casos de edema macular cistoide son leves y asintomáticos, distinguiéndose dos formas de enfermedad: la forma sintomática denominada edema macular cistoide clínico, y aquella sin repercusión clínica, en la que sólo aparecen hallazgos angiográficos, denominada edema macular cistoide angiográfico.
La AGF muestra que la fuente del edema es una permeabilidad anormal de los capilares perifoveales, observándose en los tiempos iniciales múltiples y pequeños puntos de fuga. En los tiempos tardíos se produce el llenado de contraste de los espacios quísticos situados en la capa de fibras de Henle dando lugar al característico patrón petaloide (fig. 9). Es muy común que en los casos de Síndrome de Irvine-Gass a los anteriores hallazgos se asocie una tinción del disco óptico (10).
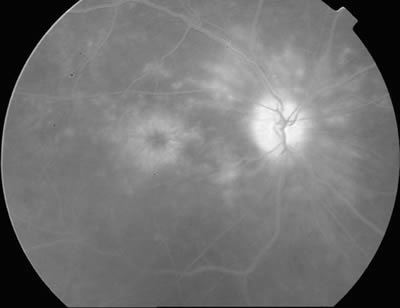
Fig. 9. AFG de paciente con síndrome de Irvine-Gass; se observa el característico patrón petaloide y la disfunción del disco óptico.
Recientemente los hallazgos obtenidos mediante OCT de esta enfermedad permiten una mejor valoración de la evolución. En la OCT se observa un engrosamiento difuso de la retina con áreas quísticas de baja reflectividad situadas en la capa plexiforme externa. En ocasiones una cavidad sin reflectividad puede ser apreciada debajo de la retina neurosensorial, con una típica disposición cónica, consecuencia del acúmulo de fluido subretiniano.
Inflamaciones y tumoraciones oculares
La AFG puede ser útil en la evaluación diagnóstica de los distintos cuadros inflamatorios intraoculares, como es el caso del síndrome de puntos blancos evanescentes. En dicho cuadro, la angiografía muestra que cada punto blanco corresponde a múltiples pequeños focos hiperfluorescentes agrupados en forma de corona, con tinción tardía (fig. 10).
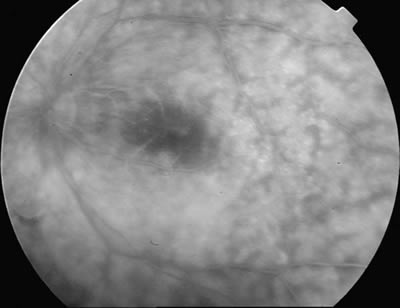
Fig. 10. AFG de paciente con síndrome de puntos blancos evanescentes.
En las vasculitis retinianas, la AFG permite valorar fundamentalmente el grado de isquemia retiniana, ayudando a planificar un posible tratamiento con láser para evitar la aparición de neovasos.
El hemangioma de coroides es otra entidad donde la AFG puede ser útil como método diagnóstico. La AFG muestra canales vasculares intralesionales que se llenan de contraste en fases muy precoces del AGF, en tiempos coroideos. Estos canales van perdiendo su identidad a lo largo de la prueba adquiriendo el fondo un aspecto similar a la otras áreas no afectas por el tumor. Sólo aquellos hemangiomas que se complican con la aparición de un desprendimiento de retina exudativo, muestran fuga en tiempos tardíos de la AGF (fig. 11).
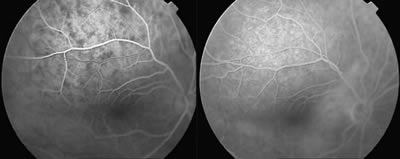
Fig. 11. Angiografía en un caso de hemangioma cavernoso. En los tiempos previos se observan el llenado de los canales intralesionales.
Finalmente la AFG puede complementar el estudio diagnóstico de los casos dudosos de masas intraoculares, especialmente en el caso de los melanomas de coroides.
Bibliografía
- Sarks JP, Sarks SH, Killingswoth MC. Evolution of geographic atrophy of the retinal pigment epithelium. Eye. 1988; 2 (5): 552-557.
- Regillo C, Chang TS, Jonson MW. Acquired diseases affectiong the macula. In: Regillo C, Chang TS, Jonson MW. Retina and vitreous 2004-2005. San Francisco : American Academy Ophthalmology; 2004; 51-95.
- Bressler NM. Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two year results of 2 randomized clinical trials-TAP report 2. Arch Ophthalmol, 2001; 119: 198-207.
- Flynn HW Jr, Smiddy WE, eds. Diabetes and ocular disease: Past, Present, and Future Therapies. Ophthalmology Monograph 14. San Francisco : American Academy of Ophthalmology; 2000.
- Aiello LM, Cavallerano J, Aiello LP. Diagnosis, management, and treatment of nonproliferative diabetic retinopathy and macular edema. In: Albert DM, Jakobiec FA, eds. Principles and Practice of Ophthalmology. 2nd ed. Philadelphia : Saunders; 2000; 747-759
- Fekrat S, Finkelstein D. Venous occlusive diasease. In: Regillo CD, Brown GC, Flynn HW Jr., eds. Vitreorretinal disease: The essentials. New York : Thieme; 1999; 117-132.
- Finkelstein D, Clarkson JG, Hillis A. Branch and central vein occlusions. Focal points: Clinical Modules for Ophthalmologists. San Francisco : American Academy of Ophthalmology; 1997, module 9.
- Hayreh SS, Klugman MR, Beri M, Kimura AE, Podhajsky P. Differentiation of isquemic from non ischemic central retinal vein occlusion during the early acute phase. Graefes Arch Clin Exp Ophthalmol 1990; 228: 210-217.
- Gass JD. Bullous retinal detachment: an inusual manifestation of idiopathic central serous choroidopathy. Am J Ophthalmol, 1973; 75: 810-821.
- Berkow JW, Flower RW, Orth DH, et al. Fluorescein and Indocyanine Green Angiography: Technique and Interpretation. 2nd ed. Ophthalmology Monograph 5. San Francisco : American Academy Ophthalmology; 1997; 117-118.
- Jampol LM, Sieving PA, Pugh D. Multiple evanescent white dot syndrome. I. Clinical findings. Arch Ophthalmol. 1984; 102: 671-674.