Reacciones adversas oculares a fármacos sistémicos
José Luis Encinas Martín, Isabel Sánchez Ronco
Introducción
Todo fármaco tiene capacidad potencial de generar efectos colaterales nocivos aún cumpliendo la normativa establecida por la FDA que exige la verificación rigurosa de la relación de riesgos y beneficios de un fármaco antes de su empleo.
Las interacciones medicamentosas son otra fuente de reacciones adversas, al tratarse de tratamientos combinados cuya interrelación puede multiplicar los efectos de otro fármaco aumentado su acción a nivel tóxico o menoscabando su efecto principal hasta convertirlo en ineficaz.
La importancia de las reacciones adversas a fármacos sistémicos queda reflejada en el siguiente dato estadístico: El 2-5% de los ingresos hospitalarios se deben a reacciones indeseables a medicamentos; el 90% son originados por fármacos de amplio uso como corticoides, antibióticos, etc. El 75% de estos casos pueden prevenirse con el uso adecuado de la medicación. La incidencia de las interacciones medicamentosas es de un 3-5% en pacientes con un numero pequeño de fármacos y de un 20% en pacientes con polifarmacia.
En Oftalmología es frecuente observar efectos secundarios a fármacos sin relación con la dosis al existir factores idiosincrásicos que producen efectos oculares indeseables de intensidad impredecible y de frecuencia muy variable.
Factores de influencia en la aparición de reacciones adversas a fármacos sistémicos:
- Naturaleza del medicamento.
- Multiplicidad del fármacos.
- Vía de administración.
- Dosis.
- Fisiopatología del paciente.
- Edad.
- Sexo.
- Antecedentes del paciente.
- Idiosincrasia.
Glosario
La terminología empleada en el estudio y descripción de toxicidad por drogas sistémicas ofrece cierta confusión al utilizar como sinónimos términos que representan efectos diferentes, aunque en ocasiones interdependientes; señalamos las definiciones básicas de conocimiento necesario en el estudio de toxicidad por drogas:
- El Índice Terapéutico. Viene determinado por la relación entre la dosis tóxica y la dosis útil, siendo necesario en cada caso adaptarlo a la patología del paciente y a su estado sistémico.
- Acontecimiento adverso. Clásicamente se define el acontecimiento adverso como un suceso médico no deseado y de cualquier naturaleza que sufre el paciente durante el tratamiento con un fármaco y que no tiene obigatoriamente relación con dicho fármaco. No tiene por tanto, necesariamente relación causal. En el contexto de Ensayos Clínicos establece la siguiente definición: «Cualquier experiencia no deseable que ocurre a un individuo durante un ensayo clínico se considere o no en relación con la investigación». Esta definición limita su marco a los Acontecimientos obsevados durante solo los procesos de Investigación.
- Reacción adversa.
- «Respuesta a un fármaco, inesperada, no intencionada y que se produce a dosis utilizadas normalmente en el hombre para la profilaxis, diagnóstico o tratamiento de enfermedades o para modificar una función fisiológica»
- Toda reaccion de intensidad, naturaleza, especificidad, gravedad o resolución señaladas en la Información Básica de Seguridad del Producto (IBSP).
- Reacción Adversa no Referenciada. La reacción no incluida en la IBSP.
- Reacción probada o definida. Toda reacción con relación temporal entre la administración del fármaco y la aparición de los síntomas o signos. Los síntomas y signos desaparecen con la supresión del fármaco y retornan con su administración. A su vez los síntomas y signos observados no tienen explicación lógica en su manifestación por otras patologías o condiciones del paciente.
Tipos de reacciones adversas según su mecanismo de producción
- Efectos colaterales. Son los efectos generados por la acción principal de fármaco ofreciendo habitualmente escasa significación clinica. Es necesario realizar su valoración en el contexto de la patología que domina cada caso.
- Efectos secundarios. Son generados por un mecanismo no dependiente de la acción principal del fármaco con significación clínica manifiesta, correspondiendo su génesis a la repercusión del efecto conseguido sobre otras funciones orgánicas.
- Reacción idiosincrásica. Representan las reacciones individuales a un fármaco por una condición específica de las características genéticas orgánicas o fisiológicas del individuo.
Criterios de causalidad establecidos por la OMS en las reacciones adversas a medicamentos
- Invalorables. Casos en los que las reacciones secundarias al fármaco no pueden evaluarse debido a una información insuficiente o dudosa que hace imposible su verificación.
- Eventuales/sin clasificación. Cuando hay alteración constatada de las pruebas de laboratorio con relación al fármaco y se encuentran en estudio nuevos datos para completar el informe.
- Poco probables. Cuadros clínicos con alteración de pruebas de laboratorio en relación incostante con la cronología de aplicación del fármaco y en los que otros tratamientos paralelos u otras patologías concomitantes pueden ser los causantes de la reacción secundaria observada.
- Posibles. Episodios clínicos con pruebas de laboratorio alteradas en relación directa y de secuencia constante con la administración del fármaco si bien existen medicaciones paralelas o patologías concomitantes con capacidad de generar las reacciones observadas.
- Probables. Cuadros clínicos con pruebas de laboratorio alteradas en secuencia de aparición relacionada con la administración del fármaco y con regresión parcial coincidente con la supresión del fármaco, sin existencia de otras patologías o medicaciones que pudieran originar las reacciones observadas. No se requiere reexposición para su positividad.
- Ciertas. Episodisos clínicos con alteración de pruebas de laboratorio y con relación directa con la aplicación del fármaco, sin existencia de otras sustancias o patologías que puedan explicar la reacción y con una respuesta marcada a la supresión del tratamiento. El episodio debe de ser definitivo farmacológicamente y fenomenológicamente, utilizándose si es necesario la reexposición para establecer la comprobación.
La reacción adversa relacionada con la dosis es una respuesta excesiva de la acción principal del medicamento o de alguno de sus efectos secundarios o colaterales y su génesis puede ocurrir por:
- Sobredosifición.
- Respuesta anómala a dosis normal.
Ambas condiciones pueden tener su origen en:
- Modificaciones Farmacéuticas en relacion con la preparación del medicamento y sus condiciones biológicas.
- Modificaciones Farmacocinéticas con origen en patologías existentes en el paciente con alteraciones graves de sus funciones renal, tiroidea, cardíaca, digestiva, etc., que aumentan o disminuyen la acción principal del fármaco.
- Modificaciones Farmacodinámicas que alteran las acciones del medicamento creando un estado de sensibilidad anormal a sus acciones y que son representadas fundamentalmente por los procesos hepáticos.
Las reacciones alérgicas o inmunológicas presentan un mecanismo semejante de aparición presisando habitualmente una repetición de administración del fármaco para desencadenar la reacción adversa. Representan un 10% del total de reacciones adversas registradas. En la reacción alérgica es característico la regresión de lso síntomas con la supresión del fármaco y su condición de independencia en la manifestaciones clínicas con la dosis.
Las reaciones adversas idicioncrásicas están basadas en la existencia de alteraciones enzimáticas que actúan en el proceso de metabolismo del fármaco estando con frecuencia ligadas a una constante genética, de raza o de edad.
Los tratamientos de larga duración con una misma medicación pueden a su vez generar situaciones reactivas que progresan hasta manifestarse con una reacción adversa:
- Reacción de adaptación.
- Fenómeno de rebote.
- Alteración de los procesos orgánicos normales.
• Farmacovigilancia
El Sistema Español de Farmacovigilancia (SEFV) se encuentra coordinado por el OMS e integrando las actividades dirigidas a recoger y elaborar las notificaciones de reacciones adversas a medicamentos (Ley 25/1990.art 58.1). El anexo I circular 15/2001 de la AEM contempla la legislación correspondiente a los Formularios de Notificación de sospecha de Reaccion Adversa para fármacos en investigación. El Anexo 8 Real Decreto de Ensayos Clinicos 561/1993 ofrece el el Formulario de Notificación de reacciones adversas.
El SEFV presenta una estructura organizativa basada en los Centros Autonómicos de Farmacovigilancia encargados de recoger las notificaciones de la zona Geográfica correspondiente a traves de las «tarjetas amarillas» enviadas a los Centros Hospitalarios y Facultativos en ejercicio. Una vez recogidas cada Centro integra las notificaciones en la base de datos FEDRA regido por el Centro Coordinador (AGEMED). La determinación de la relación de causalidad de una reacción adversa a un fármaco es una función de los Centros de Farmacovigilancia establecidos en todos los países. Existe obligación de comunicar la observación de una reacción adversa a los mismos.
Datos de notificación de una Reacción Adversa
- Intervalo administración del fármaco/reacción adversa.
- Terapias concomitantes o administradas con anterioridad.
- Respuesta observada en el paciente a la supresión de fármaco.
- Positividad o negatividad a la reexposición del fármaco.
- Existencia de otras patologías.
- Señalar si la reacción observada está ya registrada.
- Retirada o no de fármacos alternativos.
- Antecedentes de reacción al mismo fármaco.
FORMULARIOS DE NOTIFICACIÓN DE REACCIÓN ADVERSA
- Tarjeta amarilla.

- Formularios.

- Cuantificación del riesgo.
Ventajas e inconvenientes de los estudios de Investigación Clínica en Reacciones adversas.
| Tipo de Estudio | Ventajas | Incovenientes |
| Ensayo Clínico Experimental |
- Método científico. |
- Difícil desarrollo. |
| Observación De cohortes |
- Menor error de selección. |
- En estudios prospectivos es de larga duración. |
| Observación de Casos control |
- Permite estudio de varios factores de exposición. |
- Errores de selección. |
| No analíticos |
- Permite establecer nuevas hipótesis. |
- Dificultad de verificación de hipótesis con otras causas |
|
(M.ª Soledad Fernández Alfonso) |
||
REACCIONES ADVERSAS OCULARES A FÁRMACOS SISTÉMICOS
• Fármacos antimaláricos
- Cloroquina.
- Hidroxicloroquina.
Ambos fármacos han sustituido a la quinina en muchos casos como terapia antimalárica al ofrecer menor toxicidad y mayor potencia. Pueden presentar yatrogenia ocular en disitintas formas y dosis siendo mayor en las terapias con Cloroquina que con Hidroxicloroquina. Su empleo actualmente se ha reducido al aparecer cepas de P. Falciparum resistentes. Otras enfermedades tratadas con cloroquina e hidroxicloroquina son la artritis reumatoide y el Lupus eritematoso. La eliminación de ambas drogas es muy lenta, habiéndose comprobado su presencia en plasma y orina 5 años después de suspender el tratamiento.
Depósitos corneales por cloroquina
Biomicroscopía (figs. 1, 2 y 3)
- Primera fase: Depósitos puntiformes en epitelio corneal en distibución difusa.
- En tratamientos prolongados se dibujan líneas en forma de vortex situadas en el tercio inferior de la córnea.
- En fases tardías las líneas configuran una opacidad en vértice de color verde-amarillo que afecta al centro de la córnea.
Síntomas subjetivos
- Visión de halos coloreados.
- Fotofobia.
Evolución
- Los síntomas subjetivas y los depósitos corneales son reversibles y desaparecen con la supresión del tratamiento en un tiempo variable.
- No suelen presentar disminución de agudeza visual.
Diagnóstico diferencial de los depósitos corneales de cloroquina:
- Con la retinopatía de Fabry.
- Con las lineas de Hudson-Sthali.
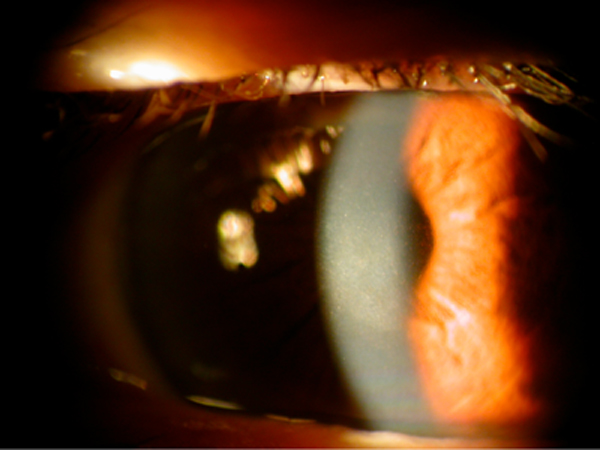
Figura 1: Depósito corneal por cloroquina.
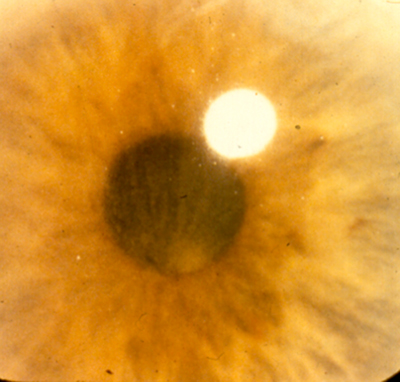
Figura 2.
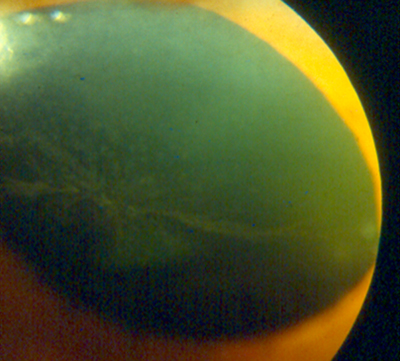
Figura 3.
Alteraciones en retina
Síntomas subjetivos:
- Escotomas centrales y periféricos.
- Disminución de agudeza visual.
- Fotopsias.
- Nictalopia.
Oftalmoscopia:
- Alteraciones pigmentarias en mácula: «Bull Eye».
- Atenuación o pérdida del reflejo foveolar.
- Pigmentación en retina periférica.
- En evoluciones avanzadas:
- Atrofia papilar.
- Disminución del calibre arterial.
- E.R.G subnormal.
- Alteraciones campimétricas periféricas. - Excepcionalmente edema macular.
Evolución:
- La supresión de tratamiento detiene el progreso de las lesiones.
- La Hidroxiloroquina presenta menor nivel de toxicidad que la cloroquina.
Otras complicaciones menos frecuentes
- Alteraciones de la acomodación.
- Diplopía.
- Opacidades de cristalino.
Dosis
- No instaurarar dosis superiores a:
- Cloroquina: 3,5 mg/Kg de peso/día.
- Hidroxicloroquina: 6,5 mg/kg de peso/día. - Dosis media límite habitualmente sin toxicidad:
- Cloroquina: 250 mg/día en menos de un año = 100 gr.
- Hidroxicloroquina: 400 mg/día durante un año=146 gr.
Prevención de las complicaciones
- Estudio previo al comienzo de la terapia.
- No superar las dosis señaladas como dosis de riesgo.
- Exploración semestral:
- A-v.
- Biomicroscopía.
- Campimetría.
- Test de colores.
- Sensibilidad de contraste.
- Rejilla de Amsler.
- E.R.G en tratamiento prolongados.
- A.F.G. si se observan alt. pigmentarias.
- Vigilancia especial en pacientes > 65 años.
- Continuación de la monitorización después de suprimir el tratamiento. - Factores de riesgo:
- Pacientes en tratamiento> 5 años.
- Existencia de enfermeda renal o hepática - Edad > a 70 años.
- Obesidad.
- MEFLOQUINA
Agente utilizado en el tratamiento de la malaria.
Reacciones adversas oculares:
- Diplopía.
- Disminución de visión.
- Fotofobia.
- Conjuntivitis.
- Eritema parpebral.
- Síndrome de Steven Jhonson.
Evolución: Efectos secundarios de escasa repercusión clinica. El 20% presentan diplopía en tratamientos de larga duración.
Dosis habitual: 1.250 mg/ en dosis única.
• FÁRMACOS ANTITUBERCULOSTÁTICOS
Los fármacos utilizados como primera elección son aquellos que presentan un nivel mínimo de efectos indeseables con un nivel aceptable de eficacia: Etambutol, Isoniazida, Rifampicina, Estreptomicina y Pirazinamida. Solo en casos de resistencias por parte de las medicaciones de primera elección se recurren a fármacos de segunda elección como Xaflocina, Ciprofloxacino, Etionamida, Ácido Aminosalicílico, Cicloserina Amikacina, Kanamicina y Capreomicina; éstos presentan mayor iatrogenia.
Estudiaremos aquellos antiberculostáticos con mayor incidencia de repercusiones oculares en admnistración sistémica.
- ETAMBUTOL
La reacción adversa más importante de este fármaco es la neuritis óptica. El mecanismo bioquímico por el cual se produce la acción tóxica sobre el nervio óptico no es bien conocida si bien se considera su acción quelante como responsable; otros quelantes como D-penicilamina, Desferrioximina y Disulfuran son causantes de neuropatías ópticas de curso y características clinicas semejantes a las provocadas por Etambutol.
Reacciones adversas:
- Neuritis óptica (1% en dosis de 15 mg/Kg).
- Papiledema. Atrofia papilar (fig. 4).
- Disminución de agudeza visual.
- Alteraciones campimétricas (dependientes de la afectación n.o.).
- Urticaria (0,5%).
- Disminución de agudeza visual (0,8%).
- Discromatopsia.
- Vasculitis retiniana.
- Alteraciones motilidad extrínseca.
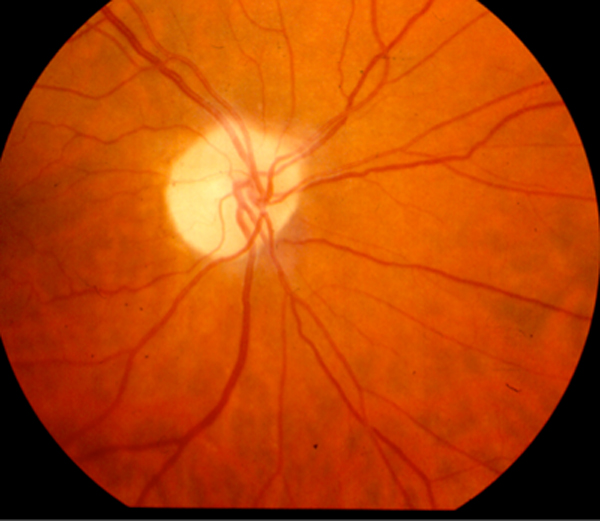
Figura 4. Atrofia óptica por Etambutol.
Evolución: La neuritis óptica suele ser bilateral. Los defectos funcionales provocados por la afectación del nervio óptico pueden permanecer varias semanas o meses a pesar de la supresión del fármaco. Se han documentado casos de ceguera por atrofia papilar.
Factores de riesgo de neuritis óptica del Etambutol:
- Neuritis óptica previa.
- Dosis superior a 15 mg/Kg/día.
- Edad avanzada.
- Alcoholismo.
- Diabetes.
- Enfermedad renal (el 70% es eliminación renal).
Dosis habitual: 15 mg/Kg de peso/día.
Dosis ajustable según las pruebas analíticas de la función renal. La aparición de neuritis óptica guarda relación directa con la dosis empleada:
- 15% de los pacientes con 50 mg/Kg/día.
- 5% de los pacientes con 25 mg/Kg/día.
- 1% con dosis de 15 mg/Kg/día.
Pauta de exploraciones: Con anterioridad al comienzo del tratamiento el paciente debe de realizar una exploración oftalmológica con verficación de:
- Agudeza visual.
- Campimetría.
- Visión de los colores.
Exploración básica cada 3 meses + PEV y ERG. El paciente debe de estar informado de los cambios posibles en su función visual y la obligación de acudir al Oftalmólogo ante la observación de los mismos.
Tratamiento de los síntomas tóxicos del Etambutol: Hidroxicobalamina en dosis de 40 mg vía parenteral durante varias semanas.
- CAPREOMICINAR
Reacciones adversas:
- Fosfenos.
- Discromatopsia.
- Angioedema.
- Disminución de visión.
Evolución: Las reacciones adversas de la Capreomicina son raras y desaparecen con la supresión del fármaco.
Dosis habitual: 15-30 mg/kg/día durante 3 meses.
- ISONIAZIDA
Es una hidrazida del ácido isonocotínico siendo el fármaco más utilizado en el tratamiento de la tuberculosis.
Reacciones adversas:
- Neuritis retrobulbar. Atrofia óptica.
- Disminución de agudeza visual.
- Defectos campimétricos.
- Midriasis (ausencia de feflejo fotomotor).
- Discromatopsia.
- Reacciones cutáneas parpebrales.
- Paresias musculatura extrínseca.
Evolución: Los efectos secundarios son de menor gravedad que con el Etambutol, sin embargo se han descrito casos de ceguera en tratamientos de larga duración. Son factores de riesgo: Alcoholismo, Diabetes, edad avanzada, desnutrición, enfermedad renal y hepática. Las reacciones adversas son menores si se administra conjuntamente Piridoxina. Al igual que en el tratamiento con Etambutol es necesario un seguimiento de las funciones visuales con PEV y ERG.
Dosis habitual: 5 mg/Kg hasta una dosis máxima de 300 mg.
- RIFABUTINA
Las rifamicinas son antibióticos extraídos del Streptomices Mediterranei: Rifabutina, Rifapentina, Rifampicina. Las Rifamicinas son también utilizadas como profiláctico de Meningitis por H. Influence, lepra y en combinación con Vancomicina en el tratamiento de endocarditis estafilocócicas.
Reacciones adversas:
- Uveítis anterior.
- Precipitados queráticos.
- Hipopión.
- Panuveítis (menos frecuente).
- Síntomas derivados de la uveítis.
- Vasculitis retiniana.
- Dermatitis de contacto. Urticaria. Despigmentación.
Evolucion: El 40% de los pacientes en tratamiento con este fármaco sufren uveítis anterior en un plazo de 65 días desde el comienzo de la terapia, siendo generalmente bilateral. Con la supresión del fármaco desaparecen los síntomas inflamatorios.
Dosis habitual: 600 mg/día en una sola dosis.
- ETIONAMIDA
Reacciones adversas:
- Alteraciones cutáneas parpebrales.
- Conjuntivitis.
- Diplopía.
- Fotofobia.
- Discromatopsia.
Evolución: Las reacciones adversas oculares de la Etionamida son poco frecuente y de escasa relevancia. Desaparición precoz de los efectos tóxicos con la supresión del fármaco.
Dosis habitual: Vía oral; 250 mg/día. Dosis maxima: 1 gr/día.
- CICLOSERINA
Reacciones adversas:
- Reacciones alérgicas palpebrales.
- Conjuntivitis.
- Tricomegalia.
- Disminución de visión.
- Hemorragias (anemia).
Evolución: La cicloserina presenta escasos efectos secundarios oculares y de poca importancia clínica desapareciendo con la supresión del fármaco o la disminución de la dosis.
Dosis habitual: 250-500 mg/dos veces día.
• ANTIBIÓTICOS
- CLORANFENICOL
Antimicrobiano extraído del Streptomices Venezuelae en 1947, se ha demostrado eficaz en sus acciones pero también causante de efectos adversos indeseables de carácter en ocasiones graves. Actualmente se utiliza en el tratamiento de infecciones severas en las cuales no existe ontra alternativa terapéutica, como Meningitis, Fiebre Tifoidea o Fiebre de las Montañas Rocosas. Entre sus efectos adversos están las discrasias sanguíneas de carácter grave incluso letal. Las reacciones adversas oculares quedan reflejadas en la tabla siguiente.
Reacciones adversas:
- Neuritis optica*.
- Defectos campimétricos: Escotomas Reducción periferica.
- Atrofia óptica.
- Discromatopsias*.
- Parálisis de la acomodación.
- Hemorragias retinianas (discrasia sanguínea).
- Retinopatía por depósito.
Evolución: Las reacciones adversas del cloranfenicol en administración sistémica se observan en niños, siendo la neuritis óptica la complicación más frecuente. Los efectos secundarios sobre nervio óptico pueden ser irreversibles en fases avanzadas de toxicidad. Se han descrito las reacciones adversas más graves con dosis acumulativas superiores a 100 gr o en tratamientos con dosis habituales de duración superior a 6 semanas.
- TETRACICLINAS
Antimicrobiano utilizado en diferentes enfermedades causadas por gérmenes grampositivos o gramgativos, Riketsias, Clamidias y Plasmodium.
Reacciones adversas:
- Miopía aguda transitoria*.
- Edema papilar (Pseudotumor cerebri)*.
- Disminución de agudeza visual.
- Queratoconjuntivitis.
- Pigmentación escleral (azul oscuro o marrón).
- Pigmentaciones conjuntivales.
- Alteraciones cutaneas parpebrales:
- Eritema.
- Fotosenbilidad.
- Decoloración.
- Pigmentación. - Parálisis musculatura extrínseca.
- Hemorragias subconjuntivales (anemia).
Evolucion: La Minociclina es la tetraciclina con mayor incidencia de pseudotumor cerebri comprobándose como reversible con la supresión del fármaco; los síntomas secundarios al pseudotumor cerebri pueden ser irreversibles. Las lesiones cutáneas de pigmentación o decoloración se sitúan en áreas de exposición y son de difícil regresión, pudiendo persitir durante años o hacerse permanentes.
- CIPROFLOXACINO. NORFLOXACINO. OFLOXACINO
Fluoroquinolonas de acción antimicrobiana sobre gramnegativos y grampositivos aerobios.
Reacciones adversas:
- Alteraciones cutaneas parpebrales:
- Eritema.
- Urticaria.
- Dermatitis exfoliativa.
- Angioedema. - Deslumbramiento.
- Agravación de los síntomas en Miastenia garvis.
- Paralisis de musculatura extrinseca.
- Nistagmus.
- Neuropatía tóxica.
Evolucion: Los efectos secundarios oculares de estos antibióticos son poco frecuentes y habitualmente fácilmente reversibles con la supresión del fármaco o la disminución de la dosis.El 15% de sus reacciones adveras son los de afectación cutanea parpebral.
- AMINOGLUSIDOS
Gentamicina. Kanamicina. Neomicina. Amikacina. Estreptomicina. Vancomicina. Tobramicina. Netilmicina.
Reacciones adversas:
• Pseudotumor cerebri.
• Atrofia optica*.
• Queratoconjuntivitis.
• Eritema parpebral.
• Perdida de pestañas y cejas.
• Urticaria.
• Disminución de agudeza visual.
• Defectos campimétricos.
• Osciloscopio.
• Ptosis parpebral.
• Parálisis de musculatura extrínseca.
Evolucion: Las reacciones adversas de los aminoglucósidos en administración sistémica son poco frecuentes y de escasa significación clínica. Uno de los efectos mas llamaativos corresponde a la Neomicina con dermatitis periocular y alergias de contacto. Su efecto de bloqueo en la trasmisión neuromuscular tiene manifestaciones no solo sitémicas sino tambien oculares. Los efectos secundarios de los aminoglucósidos son reversibles con la supresión del fármaco. La mayoria de los efectos indeseables monstrados por la Amikacina son referidos a su uso intravitreo.
- PENICILINAS
Antibiotico bactericida utilizado en infecciones causadas por distintos germenes: Estreptococo S y aureus, Meningococo Neumococo, T Pallidum, Clostridium, B. Antracis, C. difterico y Actinomices.
Reacciones adversas oculares:
- Midriasis.
- Disminución de visión.
- Diplopia.
- Alteraciones de la acomodación.
- Reacciones alergicas.
- Eritema parpebral Urticaria.
- Blerfaroconjuntivitis. - - Edema angioneurótico.
- S. de Steven Johnson.
- S. de Lyells.
Evolución: Las penicilinas ocasionan reacciones adversas oculares en muy pocas ocasiones y en su mayoria estan relacionadas con respuesta alérgicas al farmaco.Las reacciones alérgicas son mas frecuentes en alteraciones de origen inmunológico existiendo referencias especialmente en pacientes con artritis y Síndrome de Sjogren.La sintomatología de estas reacciones oculares cede siempre con la supresión del fármaco.
• ANTIRREUMÁTICOS
- SALICILATOS
Reacciones adversas:
- Visión borrosa.
- Miopía transitoria.
- Eritema parpebral.
- Edema angioneurótico.
- Urticaria.
- Síndrome de Lyells’.
- Pénfigo.
- Queratitis sicca.
- Estados tóxicos:
- Discromatopsias.
- Paralisis musculos extraoculares.
- Midriasis.
- Ausencia reflejo fotomotor.
- Defectos campimétricos.
- Papiledema.
- Ambliopia tóxica.
Evolución: Habitualmente los efectos secundarios ceden con la supresión del fármaco y solo las lesiones de nervio óptico o retina han sido descritas c como permanentes.Se han publicado casos de ceguera transitoris con duración de 3 a 24 horas.
Dosis habitual: 75-150 mg/día.
- DERIVADOS DEL ÁCIDO ACÉTICO.
Ketacorolato.
Indometacina.
Tolmetina.
Diclofenaco
- Indometacina
Antiinflamatorio no esteroideo utilizado en el tratamiento de artritis reumatoide ,espondilitis y otras enfermedades articulares degenerativas.
Reacciones adversas:
- Visión borrosa.
- Depósitos cornéales.
- Conjuntivitis.
- Queratitis.
- Pseudo tumor cerebri.
- Moteado pigmentado en retina(Macula).
- Alteraciones campimétricas.
Evolución: Los efectos secundarios de la Indometacina en su administración sistémica no tienen gran significación clínica y en muchos casos no han sido probados con certeza.
Dosis: 50-200 mg./dia.
- PIRAZOLONAS
Dipirona.
Fenilbutazona.
Reacciones adversas:
- Dermatitis.
- Reacciones alérgicas.
- Conjuntivitis.
- Eritema multiforme.
- Decoloración cutánea parpebral.
- Queratitis.
- Atrofia óptica.
- Hipermetropia (3-4 dioptrias).
Evolucion: La dosis necesaria para lograr nivel de eficacia clinica sistémica con este fármaco es muy alta siendo esta la causa de la mayoria de los efectos colaterales. Las Fenilbutazonas poseen efecto fotosensibilizante siendo necesaria protección de radiacciones ultravioleta con su uso.
Dosis habitual: 500 mg/8 horas.
- DERIVADOS DEL ÁCIDO PROPIÓNICO
Ibuprofeno.
Naproxeno.
Ketoprofeno.
Flurbiprofeno.
Aniinflamatorios no esteroideos utilizados en el tratamiento de la artritis reumatoide, espondilitis, osteoartritis y gota.
Reacciones adversas:
- Conjuntivitis.
- Dermatitis exfoliativa.
- Eritema parpebral.
- Urticaria.
- Ezcema.
- Dermatitis de contacto.
- Disminucion de visión.
- Alteraciones motilidad extrinseca.
- Queratoconjuntivitis seca.
- Empeoramiento de herpex simple.
- Neuritis óptica.
Evolución: En el tratamiento con Naxopren se han descrito defectos campimétricos y neuritis óptica con escasa frecuencia. Tanto el Naxoprofen como el Ketoprofen son agentes fotosensibilizantes. El Ibuprofen causa con mayor frecuencia neuritis óptica con disminución de visión, discromatopsias y depósitos corneales;la recuperación de agudeza visual normal se logra tras 1-3 meses de supresión del fármaco mientras que la normalidad de percepción cromática puede tardar 8 meses en la restitución completa a la normalidad.
Dosis habitual:
Ibuprofeno: 200-400 mg/6-8 horas.
Naxoprofeno: 500 mg/12 horas.
Ketoprofeno: 50 mg/12 horas.
Flurbiprofeno: 150-300 mg/dia.
• FÁRMACOS ANTICONVULSIVANTES
Clasificacion:
- Hidantoinas.
- Barbitúricos.
- Desoxibarbituricos.
- Iminoestilbenos.
- Succinimidas.
- Acido Valproico.
- Benzodiazepinas.
- Topiramato.
- Lamotrigina.
- Gabapentina.
- Felmamato.
- Tiagabina.
- Zonisamida.
Poseen unas caracteristicas farmacológicas y unos mecanismos de acción muy distintos. Actúan sobre el metabolismo de los neurotrasmisores: Modulan el funcionamiento de las bombas iónicas de las membranas neurales y regulan la fosforilación proteica.
- ETOTOÍNA
Reacciones adversas:
- Nistagmus.
- Diplopía.
- Fotofobia.
- Conjuntivitis.
- Eritema parpebral.
- Dermatitis exfoliativa.
- Síndrome de Lyell.
- Síndrome de Steven Johnson.
- Papiledema*.
Evolución: Los efectos secundarios son escasos y reversibles con la supresión del fármaco. El nistagmus puede persistir algunos días después de la suspensión del tratamiento.
Dosis habitual: 500 mg/dia hasta un maximo de 2 gr/día.
- FENITOÍNA
Es una Hidantoína utilizada en el tratamiento de las epilepsias crónicas.
Los efectos secundarios sistémicos más destacados son: Taquicardia, hipotensión y arritmias.
Reacciones adversas:
- Fotofobia.
- Nistagmus*.
- Midriasis.
- Disminución reflejo fotomotor.
- Alteraciones motilidad extrinseca.*
- Discromatopsias.
- Dolor peroorbitario.
- Hiperemia conjuntival.
- Dermatitis parpebral.
- Reacciones alérgicas.
- Acción teratogénica.
Evolución: Los efectos secundarios mas frecuentes son: Diplopia y nistagmus ; Sus efectos son reversibles con ladisminución de la dosis.El nistagmus de oscilación pequeña puede aparecer incluso con dosis medias normales mientras que el nistagmus marcado solo aparece en altas dosificacicones.
Dosis habitual:
- Oral,100 mg./8 horas/dia.
- I.V. Dosis maxima de ataque 1.5 gr/ dia; debe de monitorizarse por riesgo de aritmias.
- ACIDO VALPROICO
Los derivados del acido valproico se utilizan en el tratamiento de crisis convulsivas del pequeño mal y convulsiones mioclonicas. Presenta un grado leve de hepatotoxicidad. En agosto del 2005 ha sido publicado un estudio conjunto de varios Hospitales de los EE UU señalando la influencia favorable del Acido valproico en el tratamiento del HIV; los autores observan una reduccion importante de las celulas reservorio del HIV en pacientes sometidos a terapia antiretroviral intensa ,con enfermedad inactiva pero con celulas-reserva persistentes disminuyendo el n.º en un 75% con rango de 60% a > 85% Otros autores han señalado resultados idénticos.
Reacciones adversas:
- Diplopía.
- Nistagmus.
- Osciloscopia.
- Hemorragias.
- Efectos teratogénicos.
Evolucion: Efectos secundarios escasos y reversibles.Solo los efectos teratogénicos se han demostrado frecuentes y graves.
Dosis habitual:
- 200 mg/8 horas.
- I.V: Dosis de ataque de 15 mg/Kg en 3-5’.
- SUCCINIMIDAS
Fármaco utlizado como medicación de primera elección en crisis de ausencia.
Etosuximida.
Metosuximida.
Fensuximida.
Reacciones adversas:
- Diplopía.
- Fotofobia.
- Disminución de visión.
- Miopía.
- Edema periorbitario.
- Hemorragias retinianas (anemia).
- Dermatitis exfoliativa.
- Síndrome de Steven Johnson.
Dosis habitual: 500 mg/24 horas.
Evolucion: La Etosuximida y Fensuximida producen menor número de efectos secundarios que la Metusuximida.
- TOPIRAMATO
Utilizado en: Migraña, epilepsia y en algún caso para combatir la obesidad.En intervelo medio de aparición de los efectos secundarios es de 7 dias desde el comienzo del tratamiento siendo significativo que en el 85% de los pacientes que sufrieronestos efectos adversos lo hicieran en los 15 dias primeros de terapia.
Reacciones adversas:
- Ciertas:
- Visión borrosa.
- Glaucoma agudo.
- Miopía (hasta 8-9 dioptrias
- Diplopia y Nistagmus (dosis alta). - Probables:
- Mioquimias.
- Blefarospasmo.
- Crisis oculogiras.- Sufusión coroidea. - Posibles:
- Escleritis.
- Edema periorbitario.
Evolución: Síntomas reversibles con la supresión del tratamiento.
Dosis habitual: 25-50 mg. en dosis inicial con aumento progresivo hasta una dosis de mantenimiento de 100 -400 mg./dia.
- CARBAMACEPINA
Fármaco antidepresivo derivado del iminostilbeno utilizado en el tratamiento de la neuralgia trigeminal.
Reacciones adversas:
- Visión borrosa.
- Diplopia*.
- Nistagmus y crisis oculogiras.
- Pigmentación en retina.
- Papiledema(dosis alta).*
- Alucinaciones visuales.
- Alteraciones de acomodación y convergencia.
- Parpados:
- Eritema.
- Dermatitis.
- Púrpura.
- Reacciones alérgicas. - Efectos teratogenicos (Microftalmos, anoftalmos, coloboma n. óptico).
Dosis habitual: Inicial de 150-200 mg/dia hasta un máximo de 1 gr./dia. Toxicidad comprobada en dosis superiores a 1.2 gr/dia.
Evolución: Efectos reversibles con la disminución de la dosis o la supresión del fármaco.
• FÁRMACOS ANTIDEPRESIVOS
- TRICÍCLICOS
Fármacos utilizados en el tratamiento de estados depresivos y situaciones de ansiedad psiconeurotica constituyendo el grupo de antidepresivos mas utilizados. Sus efectos secundarios restringen su empleo: Arritmias por acción sobre la conducción A_V, hipotensión, somnolencia, alteración de la conducta, nauseas y vómitos. La dosificación debe de iniciarse con niveles bajos y aumentar progresivamente hasta alcanzar la dosis de mantenimiento;la retirada del fármaco se realizara igualmente de forma progresiva.
- Desipramina.
- Imipramina.
- Nortriptilina.
- Protiptilina.
- Amitriptilina.
- Amoxapamina.
- Clomipramina.
- Doxepin.
- Trimipramina.
Reacciones adversas:
- Midriasis.
- Cicloplegia.
- Insuficiencia de acomodación.
- Disminución de secrección lagrimal*.
- Eritema y urticaria parpebral.
- Edema conjuntival.
- Opacidades corneales.
- Hipertensión intraocular*
- En dosis alta:
• Midriasis.
• Visión borrosa.
• Neuritis.
- Interacciones: Con anestesiscos tópicos y con Noradrenalina.
Evolución: Reversible con la supresión del fármaco.
Accion teratogénica: Probabable generador de microftalmia.
Dosis haituales: 30-75 mg./dia en dosis de inicio;100-150 mg./dia en dosis de mantenimiento con un máximo de 300 mg/dia en la mayoria de los triciclitos.
- INHIBIDORES DE LA MONOAMINO-OXIDASA (IMAO)
Fármacos utilizados especialmente en los estados de depresión endógena.
• Fenelzina.
• Nialamida.
• Tranilcipromina.
Reacciones adversas:
- Alteraciones de la motilidad pupilar.
- Nistagmus.
- Diplopía.
- Visión borrosa.
- Parálisis musculatura extrínseca.
- Ptosis.
- Discromatopsía.
- Alucinaciones visuales.
- Hemorragias retinanas (anemia).
Evolución: Los efectos tóxicos se potencian con la asociación de otros inhibidores de la MAO o con otros antidepresivos. Efectos reversibles al suprimir el tratamiento.
Dosis habitual:
Fenelzina: 45-75 mg/día vía oral.
Nialamida:150-200 mg/día.
Tranilcipromina: 10-20 mg/día.
- INHIBIDORES DE LA SEROTONINA
Fármacos empleados en el tratamiento de estados depresivos,químicamente relacionados con los antidepresivos triciclitos y con menores efectos muscarinicos secundarios.
• Fluoxetina.
• Fluvoxamina.
Reacciones adversas:
- Visión borrosa.
- Diplopía.
- Queratitis seca.
- Fotofobia.
- Urticaria parpebral.
- Midriasis.
- Aumento de los movimientos oculares en sueño.
Evolución: Se trata de un fármaco de uso comun .Solo el 3% de los pacientes sometidos a tratamiento de larga distancia presentan visión borrosa frente al 1% de grupo control.Los efectos secundarios ceden con la supresión del fármaco.
Dosis habitual:
Fluoxetina: 20 mg/dia.
Fluvoxamina:50-100 mg/dia.
- METHILFENIDATO
Derivado de la pepiridina utilizado en el tratamiento del síndrome hiperkinético infantil y estados depresivos.Administración oral o intravenosa.
Reacciones adversas:
- Midriasis.
- Retinopatía por talco.
- Urticaria y eritema multiforme.
- S. de Stevens Johnson.
- Blefaroclonus.
En administración intravenosa:
- Retinopatía por Talco (émbolos en retina; hemorragias).
- Disminución de vision.
- Desprendimiento de retina traccional.
Evolución: Efectos secundarios generalmente reversibles y con escasa repercusión clinica ,excepto la retinopatía por talco que puede generar complicaciones graves y no reversibles.
Dosis habitual: 5-10 mg/dia en desayuno y comida.
- PEMOLINE
Derivado oxazolidinico utilizado en trastornos de atención.
Reacciones adversas:
- Disminución de visión.
- Diplopia.
- Nistagmus.
- Crisis oculogiras.
- Sindrome de Tourette.
Evolución: Síntomas reversibles con la supresión del tratamiento.
- TRAZODONA
Derivado de la triazolopiridina.
Reacciones adversas:
- Disminución de agudeza visual.
- Percepción de objetos con brillo.
- Alteraciones en la percepción de la imagen (Palinopsia).
- Hiperemia conjuntival.
- Sensación de cuerpo extraño.
- Fotofobia.
- Blefaroconjuntivitis.
- Diplopía.
- Hemorragias retinianas (anemia).
Evolución: Los efectos secundarios desparecen con la disminución de la dosis o la supresión del tratamiento.
Dosis habitual: 100-150 mg/dia.
• FARMACOS ANTIPSICÓTICOS
- CLORPROMAZINA
Derivado fenotiacinico utilizado en patología psiquiatrita: Cuadros Psicóticos y esquizofrenia. Presenta gran afinidad por la melanina generando pigmentación en disitintas estructuras oculares en relacion directa con la dosis y la duración de la terapia. Se ha descrito accion iatrogénica en tratamientos bajo dosis habituales con duracion superior a un año en el 30% de los pacientes y en el 100% de los que mantienen mas de 10 años de terapia con clorpromazina (1,2).
Acción tóxica a nivel de: Córnea, Cristalino, Conjuntiva, Retina, n. óptico y motilidad extrínseca.
| Alteraciones corneales | Alteraciones cristalino |
|
Síntomas subjetivos. Síntomas objetivos (4,5) - En estadios muy avanzados pueden afectar |
Síntomas subjetivos. Síntomas Objetivos (1,2,4) Grado 1: Depósitos puntiformes en cristaloides anterior. Grado 2: Granulos de pigmentación en forma de estrella. Grado 3: Pigmentación en estrella en capsula posterior blanco amarillo. Grado 4: Afectación nuclear de granulos de pigmento en estrella. Grado 5: Opacidad central con gránulos de pigmento periférico. |
| Alteraciones conjuntivales | Alteraciones en retina y n. óptico |
| - Pigmentacion en conjuntiva bulbar a nivel de hendidura parpebral (6,8) |
- Son infrencuentes. Síntomas objetivos (4,6,8): |
Otras alteraciones
- Trastornos de amodación.
- Diplopía.
Dosis
- Dosis habitual de tratamiento: 75 mg/dia (4).
- Dosis toxica:
- Dosis de 1500-2000 mg generan pigmentacion en cornea y cristalino.
- Con dosis superiores a 2500 mg.la pigmentación aparece en el 90% de los casos.
- Tratamientos continuados con duración superior a 10 años generan depósitos en el 100% de los casos aun con dosis de nivel terapéutico minimo.
- LITIO
Fármaco utilizado en el tratamiento de crisis maniacodepresivas.
Síntomas (2,5):
- Borrosidad de visión.
- Ceguera cortical.
- Exoftalmos (acción tiroidea).
- Papiledema (pseudotumor cerebri).
- Irritación conjuntival.
Evolución: La supresión del tratamiento hace regresar la sintomatología tóxica del Litio, si bien se han descrito casos de nistagmus persistentes aun después de la supresión del tratamiento.
- HALOPERIDOL. DROPERIDOL TRIFLUPERIDOL
Efectos secundarios:
- Crisis oculogiras.
- Alteraciones de la acomodación.
- Midriasis.*
- Disminución de vision.
- Reacciones alergicas parpebrales.
- Blefarospasmo.
- Catarata subcapsular.
- Miopía (Hiponatremia).
Evolucion: Síntomas de efectos secundarios reversibles sin secueleas.
Dosis habitual: 2-15 mg/dia.
- TIORIDAZINA
Se considera el derivado fenotiazinico de mayor toxicidad ocular manifestandose fundamentalmente a nivel de retina.Ha sido suspendido su uso con fecha 30 de Junio del 2005 por los graves efectos secundarios que posee.
| Alteraciones en retina (1,3,4) | Dosis |
|
Síntomas subjetivos:
Síntomas objetivos:
Pruebas electrofisiologicas:
|
Dosis habitual: -200-800 mg/ dia. Dosis maxima terapéutica: -1200-1800 mg /dia. Dosis tóxica: Con dosis total acumulativa de 80-100 gr. |
• FÁRMACOS ANSIOLÍTICOS, HIPNÓTICOS Y SEDANTES
- BENZODIAZEPINAS
Alprazolan. Clonazepan. Flurazepan. Triazolan.
Reacciones adeversas:
- Hipoestesia corneal.
- Alteraciones de la acomodación.
- Alteraciones motilidad extrinseca.*
- Midriasis.
- Conjuntivitis alérgica.
La asociación de benzodiazepinas y derivados fenotiazicinicos origina alteraciones de motilidad extrinseca de carácter conjugado .
Evolucion: Efectos revesibles al retirar el tratamiento.
Dosis habitual:
Alprazolan: Media de 2 mg/dia hasta un maximo de 6 mg/dia.
Clonazepam: 1mg/dia hasta un maximo de 6 mg/ dia.
Flurazepam:15-30 mg/noche.
Triazolam: 0.125 mg-250 mg/noche.
- BARBITÚRICOS
Fenobarbital.
Reacciones adversas:
- Paresia de musculos extrinsecos.*
- Nistagmus.*
- Insuficiencia de convergencia.*
- Ptosis parpebral.
- Miosis en dosis bajas*
- Midriasis en dosis altas.
- Disacromtopsias.*
Evolución: Los efectos de los barbitúricos se observan en tratamientos prolongados o dosis masivas o estados de intoxicación.
Dosis habitual: 60-250 mg/dia.
- HIDRATO DE CLORAL
Reacciones adversas:
- Insuficiencia de convergencia.
- Ptosis.
- Miosis en dosis bajas.
- Midriasis en dosis alta o de intoxicación.
- Neuritis.
Evolución: Efectos reversibles con la supresión del fármaco.
- BROMO
Reacciones adversas:
- Nistagmus (dosis alta).
- Diplopía (dosis altas).
- Neuritis con secuelas permantentes en intoxicación.
Evolución: En dosis bajar los efectos secundarios son reversibles. En dosis de intoxicación las secuelas son definitivas.
• AGENTES PSICODÉLICOS
- Dronabinol.
- Marihuana
- Hashish
Agentes habitualmente utilizados como drogas ilicitas o de abuso;en clinica pueden ser empleados como drogas antieméticas en pacientes bajo tratamiento quimioterápico. Con menor frecuencia se usan como sedantes o narcóticos. Su acción hipotensora mantiene una acción limitada a 3-4 horas.
Reacciones adversas:
- Alucinaciones visuales
- Discromatopsia
- Visión de color amarillo o violeta.
- Fosfenos.
- Conjuntivitis.
- Fotofobia.
- Alteraciones de acomodación.
- Esotropia.
- Diplopía.
- Miosis-Anisocoria.
Evolucion: Las reacciones adversas oculares de estos agentes tienen escasa repecusión clinica. Existen referencias bibliograficas que no encuentran efectos secundarios.Los síntomas de estas reacciones tienen carácter reversible.
- Ácido Lisérgico
- Mescalina
- Psilocibin
Reacciones adversas:
- Alucinaciones visuales.
- Palinopsia.
- Alteración en la percepción formas con distorsión de imágenes.
- Discromatopsia.
- Alteración de adaptación a la oscuridad.
- Insuficiencia de acomodación.
- Alteraciones E.R.G.y de P.E.V.
- Acción teratogénica grave.
- Midriasis. Anisocoria.
Evolución: La palinopsia puede presentarse de forma aguda y permanecer largo tiempo después de la ingestión de LSD. La percepcion anomala de imágenes puede presentarse como transitoria ,en ocasiones con larga duración y mas raramente permanecer definitivamente.
• FÁRMACOS PSICOESTIMULANTES
- Anfetaminas. Dextroanfetaminas. Metanfetamina. Fenmetrazina.
Reaccciones adversas:
- Fotofobia.
- Discromatopsia.
- Vasoconstricción.
- Trombosis venosa.
- Insuficiencia de convergencia.
- Alteración reflejo fotomotor.
- Blefarospasmo.
- Teratogenia.
Evolución: En inyección intravenosa triturados pueden producir microemblias retinianas.
- METILFEDINATO
Psicoestimulante de escaso uso clínico con caracteristicas semejantes a las anfetaminas. Riesgo de dependencia.
Reacciones adversas:
- Eritema multiforme.
- Dermatitis.
- Síndrome de Stevens-Johnson.
Evoución: Desaparición de los efectos secundarios con la supresión del fármaco.
Dosis habitual: 5 mg/dos veces dia.No tomar después de las 16 horas.
- COCAÍNA
Reacciones adversas:
- Hipoestesia corneal.
- Midriasis.
- Exoftalmos.
- Pérdida de visión.
- Embolia arteria central.
Evolución: Excepto los derivados de la embolia arterial de la retina, el resto de los efectos secundarios desaprecen con la supresión del fármaco.
- LSD. MESCALINA. PISOLICIBINA. DIMETILTRIPTAMINA
Reacciones adversas:
- Postimágenes.
- Vision borrosa.
- Diplopia.
- Percepciones visuales (alucinaciones).
Evolucion: Efectos reversibles con la supresión del fármaco.
• ANTIPARKINSONIANOS
- ANTIPARKINSONIANOS ANTICOLINÉRGICO
Benztropina mesilato. Biperideno. Prociclidina. Orfrenadina
Reacciones adversas oculares:
- Queratoconjuntivitis seca.
- Visión borrosa.
- Depósitos corneales.
Evolucion: Los efectos secundarios ceden con la supresión del fármaco.
Dosis habitual:
Benzatropina:0.5-1 mg/dia.
Biperideno:1 mh/12 horas.
Prociclidina:2.5 mg./8 horas.
Orfenadrina:100 mg./8 horas.
- AMANTADINA
Fármaco antivírico utilizado en el tratamiento del virus Influenza A; no se conoce bien su mecanismo de acción pero si sus efectos beneficiosos sobre el Parkinson al actuar sobre la liberación y recaptacion de dopamina.
Reacciones adeversas:
- Depósitos corneales subepiteliaes.
- Queratitis puntata.
- Edema corneal.
- Alucinaciones visuales liliputienses.
- Disminuión de agudeza visual.
- Crisis oculogiras.
- Eritema parpebral.
- Pérdida de pestañas y cejas.
- Midriasis.
Evolucion: Los síntomas de estas reacciones adversas aparecen a las dos semanas de comenzar el tratamiento y desaparecen de 2 a 5 dias de la supresión del fármaco. El uso discontinuo del medicamentp puede evitar las reacciones. La disminución de agudeza visual es el síntomas con tiempo mas largo de desparicion aun con la supresión del fármaco pudiendo llegar a 5 -6 semanas.
Dosis habitual: Inicial 100 mg./dia una semana, continuando con 200 mg/dia.
- LEVODOPA/CARBIDOPA
Es un precursor metabólico de la dopamina ampliamente utilizado en el tratamiento del Parkinson;tanto los efectos beneficiosos sobre la enfermedad como los efectos secundarios son generados por su acción de descarboxilacion hasta dopamina. La asociación con carbidopa potencia su acción y mejora el temblor.
Reacciones adversas:
- Midriasis (Comienzo del tratamiento).
- Miosis (Tratamiento prolongado).
- Aumento de la hendidura parpebral.
- Diplopía.
- Alteración de la motilidad extrinseca.
- Blefaroclonus.
- Crisis oculogiras.
- Alucinaciones visuales.
- Reacciones alergicas.
- Síndrome lupoide.
- Ambliopia.
Evolución: Los efectos secundarios son reversibles y con grado muy variable en cada paciente aun con identica dosis. Siendo un intermediairio en la síntesis de la melanina se discute su accion en la genesis y desarrollo de los melanomas.
Dosis habitual: 100-125 mg/3 veces dia (Sinemet).
- SELEGILINA
Es un inhibidor selectivo de la MAO-B en dosis habituales;en dosis altas se muestra tambien como inhibidor de MAO-A. Se utiliza en el tratamiento de la Enfermedad Parkinsoniana como monoterapia en pacientes como síntomas leves o asociado a Levodopa para disminuir la intensidad de las manifestaciones del final de la ultima dosis.Posee efectos secundarios en forma de mareos, vómitos, disquinesias y dolor abdominal.
Reacciones adversas:
- Vision borrosa.
- Fotofobia.
- Discromatopsia.
- Blefarospasmo.
- Alucinaciones visuales.
- Córnea verticilta (poco frecuente).
Evolución: Sus fectos secundarios oculares tienenn escasa repercusión clinica y son reversibles con la supresión del fármaco incluso con tratamiento discontinuo.
Dosis habitual: 5 mg/12 horas.
• FÁRMACOS GASTROINTESTINALES
- ANTAGONISTAS DE LOS RECEPTORES H2
Cimetidina. Ranitidina. Famotidina
Las reacciones secundarias de estos fármacos son poco frecuentes y de baja significación clinica considerando la utilización comun en gran numero de pacientes con ulcera duodenal. La Cimetidina posee mayor numero de interacciones que otros antagonistas H2 y entre los efectos secundarios sistémicos destanca la posibilidad de originar impotencia y ginecomastia en varones asi como estados de confunsión en pacientes de edad avanzada sometidos a dosis altas. La Cimetidina se ha utilizado como terapia de papilomatosis conjuntivales en dosis de 30 mg/Kg/dia con buenos resultados logrando la desaparición de las lesiones en un tiempo medio de 2-3 meses al acturar como moduladores de la respuesta inmune a la infección.
Reacciones adversas:
- Disminución de visión.
- Fotofobia
- Dermatitis
- Alteraciones de acomodación
- Midriasis.
- Conjuntivitis inespecifica.
- Discromatopsia.
Evolución: Las manifestaciones secundarias desaperecen con la supresión del fármaco en todos los casos Dosis habitual: Cimetidina:200-400 mg./12 horas. Famotidina:40 mg/24 horas. Ranitidina:150 mg./12 horas.
- ANTIÁCIDOS
Sales de Bismuto.
Reacciones adversas:
- Coloración azulada de párpados.
- Coloracion azulada de conjuntiva.
- Dermatitis exfoliativa.
- Síndrome de Lyell`s.
- Depósitos corneales.
- Pérdida de cejas y pestañas.
Evolución: Los síntomas desparecen con la supresión del fármaco y solo ofrecen significación clinica en los estados de intoxicación.
Dosis habitual: 240 mg/12 horas.
- ANTIEMÉTICOS
Metoclopramida.
Reacciones adversas:
- Crisis oculogiras.
- Diplopía.
- Paralisis musculatura extrinseca.
- Nistagmus.
- Discromatopsia.
- Edema y urticaria parpebral.
- Quemosis conjuntival.
Evolución: Síntomas habitualmente de escaso relieve y facil desparición con la suspresión del fármaco.
Dosis habitual: 10 mg/8 horas.
- ATIESPASMÓDICOS
Atropina. Belladona.
Agentes anticolinergicos utilizados en el tratamiento de estados espásticos de tracto digestivo y en algunos casos de ulcus gástrico.
Reacciones adversas (administración sistémica):
- Midriasis.
- Ausencia de reflejo fotomotor (en intoxicación).
- Parálisis de la acomodación.
- Fotofobia.
- Disminución de secreccion lagrimal.
Evolución: Desaparición de síntomas con la supresión del fármaco. En su administración sistémica las reacciones oculares secundarias son escasas y de menor importancia si bien se ha descrito un caso de perdida total de la visión después de una inyección intravenosa de atropina.
Dosis habitual: 0,1 -1 mg.
- ESTIMULANTES DEL TRACTO GASTROINTESTINAL
Carbacol
Agente parasimpaticomimético derivado del amonio cuaternario utilizado en el tratamiento de estados de atonía intestinal.
Reacciones secundarias:
- Alteraciones de la acomodación.
Evolución: Las reacciones secundarias en administración sistémica del Carbacol son muy raras y menos intensas que las observadas en su aplicación tópica.
• FÁRMACOS ANTINEOPLÁSICOS
Clasificación
| I. Agentes Alquilantes | II. Antimetabolitos | III. Productos naturales | IV. Complejos de platino | V. Hormonas y Agentes analogos |
|
- Mostazas Nitrogenadas:
- Etileniminas:
- Alquilosulfonatos:
- Nitrosoureas:
|
- Análogos del ácido fólico:
- Análogos de la Pirimidina:
- Análogos de la Purina:
|
- Antimitóticos:
- Eipodofilotoxinas:
- Analogos de la Camptotecina:
- Antibioticos:
- Enzimas:
|
|
|
Fármacos Antineoplásicos con repercusión ocular
- Busulfan
- Carmustina
- Ciclosfomamida
- Clorambucil
- Cisplatino
- Daunorobicina
- Fluoroacilo
- Interferon
- Mitomicina
- Mercaptopurina
- Metrotexato
- Paclitaxel
- Procarbazina
- Tiotepa
- Vimblastina
- Vincristina
- BUSULFAN
Fármaco alquilante utilizado en el tratamiento de leucemias granulociticas.
Reacciones adversas:
- Catarata subcalsular (policromática)
- Queratoconjuntivitis sicca.
- Hiperpigmentacion parpebral.
- Dermatitis exfoliativa.
- Angioedema.
- Efectos teratogénicos (muy poco frecuentes).
Dosis habitual: 2-8 mg/dia.
Dosis toxica: 2-6 mg/dia durante mas de tres meses.
- CARMUSTINA. LOMUSTINA
Reacciones adversas:
- Vasculitis segmentaria en retina.
- Oclusiones vasculares etinianas.
- Disminución de vision o perdida.
- Edema macular.
- Proctosis ocular y dolor.
- Blefaroconjuntivitis. Eritema parpebral.
- Lagrimeo y fotofobia.
- Neuritis.
Dosis habitual: 150-200 mg/dia, I.V. en dos horas/semana.
Dosis tóxica: Dosis acumulada superior a 370 mg/m2
- CLORAMBUCIL
Reacciones adversas:
- Queratitis.
- Hemorragias en retina.
- Alteraciones motilidad extrinseca.
- Papiledema*
Dosis habitual: 01-02 mg/Kg/dia durante 3-6 semanas.
- CISPLATINO, CARBOPLATINO
Reacciones adversas:
- Toxicidad retiniana (ERG) (84%).
- Visión borrosa (62%).
- Discromatopsia (23%).
- Pigmentación macular (45%).
- Neuritis optica.*
- • Neuropatía isquémica (con inyección intracarotidea) (15-60%).
Evolución: Síntomas reversibles al retirar el fármaco.
Dosis habitual: 20 mg/m2 durante 5 dias.
- CICLOFOSFAMIDA
Reacciones adversas:
- Visión borrosa (27%).
- Queratoconjuntivitis sicca (50%).
- Pupila puntiformes (acción parasimpaticomimética).
- Alteraciones vasculares en retina.
Dosis habitual: 3 mg/kg/dia.
- DOXUROBICINA. DAUNOROBICINA
Reacciones adversas:
- • Lagrimeo.
Dosis habitual: 70 mg/m2/tres semanas.
- 5-FLUOROACILO
Reacciones adversas:
- Queratitis (25-38%).
- Conjuntivitis.
- Síndrome irritativo anterior.
- Dolor ocular.
- Visión borrosa.
- Nistagmus.
- Neuropatía óptica.
- Blefarospasmo.
Dosis habitual: 750 mg/m2/semana durante 5-6 semanas.
- INTERFERON
Reaccciones adversas:
- Disminución de vision
- Dolor ocular.
- Conjuntivitis (4% de los pacientes)
- Hipertricosis
- Neuritis óptica
- Retinopatía isquémica
Evolucion: Desaparición de los síntomas 2 semanas a 3 meses de suspender terapia.
Dosis habitual: 2,5 a 5 millones de UI/m2. Vía subcutánea. 3/semana/4-6 semanas.
- MERCAPTOPURINA. TIOGUANINA
Purina empleada en el tratamiento de la leucemia aguda
Reacciones adversas:
- Pigmentación parpebral.
- Icterus conjuntival.
- Discromatopsias eje rojo verde.
- Hemorragias retinianas (anemia)
- Efectos teratogenicos: Microftalmia. Queratopatia.
Dosis habitual:
Mercaptopurina: 5 mg./kg/dia.
Tioguanina:100 mg./m2/12 horas/8 dias.
- METROTEXATE
Reaciones adversas:
- Edema peoribitario
- Dolor ocular.
- Fotofobia.
- Hiposercreccion lagrimal (25%)
- Blefaroconjuntivitis.
- Neuropatía optica
- Edema macular.
Dosis habitual: Via oral:2-5 mg/dia durante 5 dias. Via I..:10 mg/semana.
Evolucion: Habitualmente reversibles en dos semanas.
- MITOMICINA C
Reacciones adversas:
- Visión borrosa (4%)
- Hiperemia conjuntival(4%)
- Toxicidad retiniana(70%)
- Edema papilar(Con admenistracion intracarotidea)
- Hemorragias intraretinianas.
Dosis habitual:10-20 mg./m2/dia
- PACLITAXEL (Taxol)
Fármaco anticancerígeno utilizado en ditintos tipos de neoplasias en estadios avanzados. Administración sistémica intravenosa.
Reacciones adversas:
- Disminución de agudeza visual.
- Escotomas scintilans.Moscas o luces parpadeantes.
- Alteraciones potenciales evocados visuales.
- Neuropatía óptica*
Dosis habitual: 175 mg/m2 en infusión de 3 horas.
Evolución: Aparición habitual en la ultima media hora de infusión con carácter bilateral y desparición precoz observandose solamente en el 20% de los casos sometidos a dosis habitual..Las lesiones de n.óptico suelen ser irreversibles.
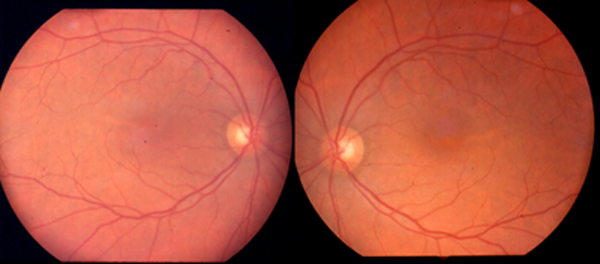
Figura 5: Edema macular por Plaquitaxel.
- PROCARBAZINA
Fármaco utilizado en el tratamiento del linfoma de Hodgking y otras patologías linfomatosas.
Reacciones adversas:
- Hemorragias retinianas (anemia)
- Hemorragias conjuntivales(anemia)
- Eritema y urticaria parpebral.
- Hiperpigmentación parpebral.
- Dermatitis.
- Pérdida de pestañas y/o cejas.
- Nistagmus.
- Fotofobia.
- Diplopia.
- Alteraciones de acomodación.
- Edema papilar.
- Alucinaciones.
Evolucion: La mayoria de los efectos secundarios con reversibles en corto periodo de tiempo con la utilización unica del fármaco en dosis habituales.
- TAMOXIFEN
Es un antiestrogénico no esteroideo utilizado habitualmente en el tratamiento del cancer de mama.Su toxicidad ocular se manifiesta fundamentalmente a nivel de retina y nervio optico (6).
| Alteraciones en retina | Alteraciones en nervio Óptico |
|
Síntomas subjetivos:
Oftalmoscopia (4,7,8)
Cornea: Depositos corneales. |
Síntomas subjetivos (9):
Oftalmoscopia:
|
| Evolución | Histopatotología |
|
|
Dosis tóxica (1-4):
- Dosis terapeutica habitual:10-20 mg/dia.
- Dosis toxica media: 60-100 mg/dia durante 12-18 meses,
- Dosis de 20 mg/dia durante 8 años se han monstrado tóxicas.
- VINCRISTINA. VINBLASTINA
Reaccciones adversas:
- Paralisis pares craneales(50%)
- Oftalmoplegia internuclear.
- Hipoestesia corneal.
- Neuropatía optica.
- Hemeralopia
- Ceguera cortical.
- Uveitis
Evolucion: Atrofia optica se ha decrito como irreversible.El resto de los síntomas son reversibles al superimir el fármaco..
Dosis habitual:
- Vincristina: 1-2 mg./m2/semana
- Vinblastina: 3,7 mg/m2/semana
• ANTIARRÍTMICOS
Antiarrítmicos con toxicidad ocular
- Amiodarona.
- Quinidina.
- Disopiramida.
- Tocaidina.
- Flecaidina.
- Mexiletina.
- AMIODARONA
Es un derivado del benzofuran empleado en el tratamiento de las arritmias supraventriculares y ventriculares.Presenta facil toxicidad ocular.La amiodarona es un análogo estructural de la hormana tiroidea pudiendo explicarse sus efectos aniarrítmicos y tóxicos por interacción con los receptores de la hormona tiroidea.Se concentra con facilidad en muchos tejidos por su carácter lipófilo y presentan una involución de depósito y de regresión de sus acciones muy lenta.La toxicidad ocular se ha relacionado tanto con la cantidad de dosis como con la dosis acumulativa es decir con el tiempo de duración del tratamiento.La dosis terapeútica media de sostén es de 100-400 mg dia y la dosis de saturación es de 800-1600 mg dia en 2-4 semanas .Las referencias sobre la presencia de neuropatía isquémica en paciente en tratamiento con Amiodarona son controvertidas;es difícil diferenciar esta neuropatía de las formas isquemicas que los pacientes tratados puden sufrir debido a su enfermedad vascular de base.Feiner describe un 1,76% de neuropatía optica en pacientes tratados con amiodarona durante un tiempo de 1 a 72 meses mientras que en un grupo control no tratado con Amiodarona y edad similar se registro una incidencia de 0,3% (el desconocimiento de los mecanismos de la amiodarona para generar neuropatía optica, la baja frecuencia de su observación y la similitud clínica con la N. ópticas isquemicas hace que se hoy un diagnostico controvertido si bien en el Sistema de Farmacovigilancia de los EE UU y consecuencia de un caso de atrofia papilar en paciente bajo tratamiento de Amiodarona ,haya sido incluida la neuropatía como reaccion adversa al fármaco y se hayan establecidos omo obligatorios los controles de agudeza visual, campimetria y vision de los colores.
Los efectos secundarios sistémicos son dependientes de la dosis y de la duración del tratamiento siendo destacables los siguientes: Fototoxicidad cutanea;disfunción tiroidea;fibrosis pulmonar y alteraciones hepáticas.
Reacciones adversas oculares:
Ciertas:
- Queratopatía por depósito (98%).
- Fotofobia (3%).
- Agrava queratoconjuntivitis sicca (2%).
- Halos coloreados (1%).
- Visión borrosa (1%).
- Pigmentación periocular de piel.
Probables:
- Maculopatia de depósito
- Nistagmus
- Queratoconjuntivitis sicca.
- Opacidades subcapsulares posteriores
- Pérdida de pestañas y cejas
- Neuropatía optica
- Pseudotumor cerebri
Posibles:
- Reacción autinmune
Evolucion: La supresión del fármaco hace reversible los síntomas con un curso muy lento.
Queratopatía por amiodarona (figs. 6, 7, 8 y 9).

Figura 6.
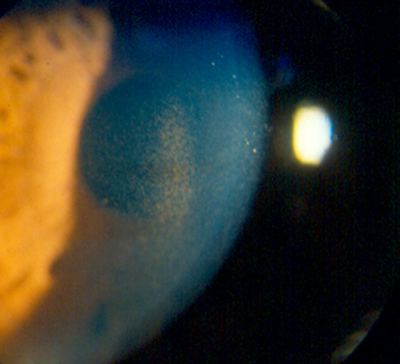
Figura 7.
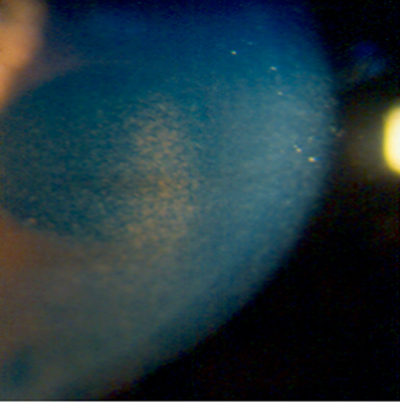
Figura 8.

Figura 9.
- Microdepósitos de liposfuscina a nivel de epitelio corneal*.
- Comienzo habitual a los tres meses de tratamiento.
- Biomicroscopia:
Grado I: Linea horizontal formada por depósitos de color pardo dorado en epitelio corneal y localizada en la unión de tercio medio e inferior de la cornea.
Grado II: Depósitos en lineas (6 a 12) con crecimiento hacia limbo.
Grado III: Las lineas de depósito se organizan en forma de vortice aumentando su densidad y numero.
Grado IV: Los depósitos forman acúmulos redondeados de distribución variable por toda la cornea,
Síntomas subjetivos:
- Disminución de visión en grados III y IV.
- Discromatopsia.
- Halos coloreados.
- Disminución del reflejo corneal.
Evolución: La supresión del fármaco hace revesible los efectos secundarios con un ritmo muy lento.Tiene una eliminación muy lenta manteniendo su acción incluso un mes después de la supresión del tratamiento.La distribución de los depósitos cornéales de amiodarona se pueden observar con una morfología semejante en tratamientos cronicos con cloroquina,indometacina o fenotiacidas.
Dosis habitual: Oral. 600 mg./dia en tres tomas
Las caracteristicas diferenciales de los depositos cornéales por Amiodarona, Cloroquina y Fenotiacidas quedan reflejadas en el cuadro siguiente:
| Amiodarona | Cloroquina | Fenotiacidas | |
|
Localización del depósito |
Localizacion epitelial. 1/3 inferior con 2/3 sup. No afectación m.de Bowman. |
Zona inferior de la cornea. Si afectación de M.de Bowman. |
Depósitos mas intensos en el centro que en periféria. Zona de hendidura p |
|
Color y morfología de los depósitos |
Color amarillo-marron en vértice. |
Puntos blanco-gris en estrias |
Gránulos blanquecinos en lineas horizontales |
|
Frecuencia |
90% de los pacientes > 3 meses con 600 mg./día |
Variable: 10 a 80% |
Variable:10-70% de los pacientes |
|
Reversibilidad |
A los 10 meses estadio I A los 20 meses estadio II. |
Reversible en 2 meses. ee media |
No es reversible. |
- QUINIDINA
Derivado de la quinina utilizado en tratamiento de las arritmias supraventriculares y ventriculares.Actualmente su empleo se encuentra restringido debido a los numerosos efectos secundarios siendo fármaco de 2.ª eleccion.
Reacciones adversas oculares:
- Queratoconjuntivitis sicca
- Ambliopia tóxica
- Discromatopsia.
- Ecotomas.
- Maculopatia tóxica*
Dosis habitual: 250 mg./8 horas.
- DISOPIRAMIDA
Fármaco antiarrítmico utilizado como tratamiento de mantenimiento.Su acción antimuscarinica lo contraindica en glaucoma.
Reacciones adversas oculares:
- Midriasis(glaucoma de angulo cerrado)
- Fluctuaciones agudeza visual.
- Agravamiento de los síntomas de la miastenia .
- Efectos reversibles.
Dosis habitual: 300-800 mg./dia en 3 dosis.
- FLECAIDINA
Medicación empleada en terapia antiarritmica en pacientes con patología cardiaca de base.
Reacciones adversas oculares:
- Vision borrosa.
Dosis habitual: 5 mg con dosis adiccionales hasta un total de 30 mg.
- MEXILETINA
Fármaco utilizado en el tratamiento de arritmias ventriculares presenta numerosos efectos secundarios a nivel del SNC y Gastrointestinales.
Reacciones adversas oculares:
- Diplopía
- Vision borrosa y fluctuante.
Dosis habitual: I.V..100-250 mg. a 25 mg./minuto.
• GLUCÓSIDOS CARDÍACOS
- DIGOXINA. DIGITOXINA. OUBAINA
Son fármacos empleados clásicamente como caridiotónicos extraidos de la Digitales Lamata y Purpúrea. La digoxina es prácticamente el único digitalico utilizado en la actualidad.
Reacciones adversas:
- Fotofobia.
- Visión borrosa.
- Escotomas centelleantes
- Discromatopsia en el eje amarillo-azul en el 80% de los tratamientos de largo plazo.Se trata de la manifestación de mayor precocidad de aparición.
Evolución: Reversibles con la supresión del fármaco.
Dosis habitual: 1-1,5 mg/día con controles plamáticos de nivel.
• ANTAGONISTAS DE LOS CANALES DEL CALCIO
Fármacos con acción sobre los mecanismos de incorporación del calcio a las celulas.Constituyen un grupo de medicamentos de carateristicas farmacólogicas muy varibles y que ejercen su acción en distintos eslabones de la cadena del Calcio.
- NIFEDIPINO. VERAPAMILO. DILTIAZEN
Reacciones adversas:
- Visión borrosa.
- Hiperemia conjuntival.
- Edema periorbitario. (1)
- Isquemia retiniana transitoria.
- Dificultad mayor de control de la P.I.O.
Dosis habitual: Vía oral.
Nifedipino:10 mg/8 horas.
Verapamilo:250 mg/dia en tres dosis.
Diltiazen:30 mg./6 horas.
• AGENTES HORMONALES
- CORTICOIDES
Las gandular suprarenales sintetizan dos tipos corticosteroides: Corticoides (glucocorticoides y mineralocorticoides) y los androgenos. Los corticoides son apliamente utilizados en numerosos procesos patológicos con especial indicacion en el tratamiento de patologías inflamatorias, alérgicas y en insuficiencia suprarenal. En su administración sistémica ofrecen importantes repercusiones oculares tanto de repercusión general como oculares siendo aconsejable que el uso de corticoides siga las reglas básicas establecidas de minima dosis útil y menor tiempo posible de terapia. Las dosis empleadas varian de 2 mg a las megadosis de 1gr en dependencia de la apología tratada.
Corticoides de uso más frecuente: Caracteristicas
| Tipo de corticoide | Dosis equivalente (mg) |
Vida media (horas) |
Dosis supresión eje HHA |
|
Cortisona Hidrocortisona Prednisona Prednisolona Metilprednisolona Triancinolona Dexametasona Betametasona |
25 20 5 5 4 4 0.75 0.6 |
8-12 8-12 18-36 18-36 18-36 18-36 36-54 36-54 |
20-32 20-32 7.5 7.5 6 6 1 1 |
Reacciones adversas oculares:
- Catarata subcapsular posterior (fig. 10).
- Hipertensión intraocular
- Favorecen las infecciones locales
- Midriasis.
- Miopía
- Alteración de la motilidad extrinseca.
- Ptosis
- Alteraciones campimétricas
- Coriorretinopatía Serosa Central
- Efectos teratogénicos (catarata)
- Empeoramiento de la Retinopatia de la prematuridad.
Evolución: En terapias de larga duración la cataratas se observan entre el 10-30% siendo el mayoria de los casos opacidades sin grave repercusión en la función visual;un 7% precisan cirugía.

Figura 10: Catarata corticoidea.
- ESTRÓGENOS Y PROGESTÁGENOS
Reacciones adversas:
- Disminución de visión.
- Alteraciones vasculares de retina:
- Oclusión de arteria retiniana
- Trombosis vena retininiana..
- Hemorragias.Periflebitis
- Edema msculsr
- Pseudotumor cerebri(Papiledema).
- Discromatopsias.
- Reacciones alérgicas parpebrales,
- Alteraciones de la acomodación.
- Aumento secreccion mucosa lagrimal.
- Intolerancia a las lentes de contacto.
Evolucion: La frecuencia de alteraciones retinianas vasculares en pacientes con terapias anticonceptivas se ha probado mayor si las pacientes presentan historia anterior de migraña.No se aconseja el uso de esos fármacos en pacientes con anomalías vasulares retinianas.
Dosis habitual: Estrógenos conjugados:0.625 mg/dia.
Estrógenos transdérmicos: 0,05 mg/2 veces/día.
- ANDRÓGENOS
Utilizados en: Endometriosis, Angioedema hereditario y enfermedad fibroquística de mama.
Reacciones adversas oculares:
- Pseudotumor cerebri.
- Papiledema.Atrofia papilar.Defectos campimetricos.
- Disminución de agudeza visual
- Diplopia.
- Eritema parpebral.
Evolucion: La aparición del pseudotumor cerebri y papiledema parace relacionada con el efecto sobre la retención de liquidos y yatrogenia trombogénica que presenta el fármaco.Puede iniciarse durante el tratamiento y poco tiempo después de su supresión. La terapia con diuréticos permite en muchos casos continuar el tratamiento.
• ANTIHISTAMÍNICOS
La síntesis de antagonistas de los receptores Hiataminicos han permitido modular las reacciones hitaminicos a traves de sus tres tipos: H1 en reacciones alergicas;H2 en trastornos gastricos y H3 aun en fase experimental y no aplicable actualmente en humanos.
Antagonistas de los receptores H1 más representativos.
- Triciciclicos y Dibenzoxepinicos: Doxepin,
- Etalonamidas:Difenhidramina
- Etilendiaminas:Pirilamina.
- Alquilaminas:Clorfeniramina.
- Piperazinas 1ª generacion:Clorciclicina
- Piperazinas 2ª generacion:Cetirizina
- Piperidinas de 1ª generacion:Ciproheptadina
- Piperidinas de 2ª generacion.Terfenadina.
- Fenotiazinas:Prometazina
- Cetirizina. Loratadina. Pirilamina. Antazolina. Tripelenamina. Ciproheptadina. Azatadina
Antagonistas de los receptores H1 utilizados en el tratamiento de rinitis alergicas, urticarias ,dermamatitis alergicas, edema angioneurótico y reacciones vasomotoras cutaneas.
Reacciones adversas:
- Alteraciones pupilares:Midriasis.Alt.reflejo* fotomotor.
- Glaucoma
- Disminución de agudeza visual.
- Diplopia.
- Alteraciones de acomodación*.
- Eritema parpebral.
- Irritacion conjuntival.
- Nistagmus y estrabismo(estados toxicos)
- Blefasroespasmo.
- Hiposecreción lagrimal*.
- Alucinaciones(estados toxicos)
- Crisis oculogiras(Cetiricina)
Evolucion: Las reacciones adversa de los antonistas H1 son poco frecuentes y su manifestación clinica puede desaparecer con la dismunución de la dosis incluso manteniendo niveles terapeuticas .Los cambios pupilares se general por su efecto atropínico con grado de manifestación ligado a la dosis acumulativa de forma en su efecto es mayor con tratamientos de larga duracion (1-9).
- Clorfeniramina. Bromofeniramina. Feniramina. Triprolidina
Derivados alquilaminicos de accion antihistamínica utilizados en el tratamiento de procesos alergicos como rinitis,conjuntivitis y reacciones cutaneas.
Reacciones adversas:
- Disminución de agudeza visual.
- Midriasis. Anisocoria. Disminucion reflejo fotomotor.*
- Dismunución secreccion lagrimal*.
- Diplopía.
- Eritema parpebral.
- Sensación de escozor.
- Queratitis puntata.
Evolución: Reacciones poco frecuente y de escasa revancia clinica.Sus efectos son reversibles incluso pueden desaparecer sin la supresión del fármaco.
• AGENTES REGULADORES DEL CALCIO
- Bifosfonatos
Son inhibidores de la reabsorción osea utlizados en distintas patologías: Cáncer de accion osteolitica para control de la hipercalcemia; osteoporosis ligada a los trastornos hormonales de la menopausia; enf. De Paget,mioloma multiple y otras patologías que cursan con hipercalcemia por osteolisis. En 1999 se conocen tres casos de escleritis en pacientes sometidas a tratamiento con a.alendronico por osteoporosis ligada a la menopausia (Rev. PAM Salud pública.); las pacientes presentaban dolor ocular,diplopia y edema parpebral con relacion temporal directa entre la administración de a.alendronico y la aparicion de los síntomas y relacion directa con la desaparición de los síntomas a la supresión del medicamento.Todos los bifosfonatos pueden originas reacciones adversas semejantes a las descritas.
Reacciones secundarias más relevantes:
- Epiescleritis.(Via I.V.Aparicion en 48 horas en el 82% de los pacientes)
- Uveítis.
- Conjuntivitis.
Reacciones secundarias de los distintos tipos de Bifosfonatos
- Pamidronato:
Conjuntivitis
Uveitis
Vision borrosa
Escleritis y epiescleritis.
Dolor y fotofobia. - Ácido alendrónico:
Visión borrosa.
Dolor ocular
Conjuntivitis
Uveitis.
Escleritis. - Etidronato:
Visión borrosa
Conjuntivitis. - Risedronato:
Conjuntivitis
Visión borrosa
Escleritis - Clodronato:
Visión borrosa.
Fotofobia.
O.M.S.: Clasificacion de las reacciones a Bifosfonatos
Ciertas:
- Visión borrosa
- Conjuntivitis.
- Fotofobia
- Epifora.
- Uveitis.*
- Escleritis y epiescleritis.*
Probables:
- Edema parpebral y/o orbitario.
Posibles:
- Neuritis óptica.
- Discromatopsia.
- Diplopia.
- Ptosis parpebral.
Evolucion: Las reacciones mas severas y frecuentes son la escleritis y uveitis pudiendo presentarse con carácter uni o bilateral.Se han resgistrado aparicion de los síntomas indeseablea a las 6-48 horas de la administración intravenosa.
• RETINOIDES
Fármacos empleados en el tratamiento del acné,soriasis y leucemia.Acción tóxica mas frecuente en niños con aparición habitualmente a los 2-3 meses de tratamiento en dosis terapéutica.Las tretaciclinas potencian los efectos adversos.
Retinoides que producen Hipertensión endocraneal
- Ácidos trans-retinoicos (Vit A): Dosis:45 mg/dia.Aparicion: 540 dias.
- Acitretina: Dosis 45 mg/m2/dia. Intervalo de aparicion:Variable.
- Tretionina:Dosis:45 mg/m2/dia. Intervalo de aparicion variable.
- Etretinato:Dosis 0.75-1 mg/Kg/dia. Intervalo de aparicion:90 dias.
- ISOTRETIONINA
Fármaco utilizado en el tratamiento de acne, psoriasis y algunos tipos de leucemia.
Reacciones adversas:
Ciertas:
- Alteración ERG escotópico.
- Blefaroconjuntivitis.
- Opacidades corneales.
- Disminución de adaptación a la oscuridad.
- Alt. galdulas de Meibomio.
- Miopia.
- Hipertensión endocraneal
- Fotofobia.
- Sequedad ocular. Queratitis.
Probables:
- Discromatopsias.
- Pérdida total de la adaptación a la oscuridad
Posibles:
- Exoftalmos.
- Glaucoma
- Ulceras corneales.
- Diplopía
- Neuritis.
Evolución: Las reacciones adversas oculares solamente se observan en tratamientos muy prolongados y remiten a la normalidad con la retirada del fármaco.
• AGENTES DE LA DISFUNCIÓN ERÉCTIL
- Sildenafilo
El Sildenafilo inhibe el acúmulo de la fosfodiesterasa 5 (PDE-5) favoreciendo los mecanismos del cuerpo cavernosos que aumentan el flujo sanguineo y la erección;pero el Sildenafilo tambien es inhibidor en menor grado de la PDE-6, isoenzima que actua en los procesos de trasmisión de los fororeceptores explicando la repercusión intensa que este fármaco tiene sobre la percepción de los colores, el brillo y la luminosidad.El metabolismo del Sildenafilo es modulado por la isoenzima CYP3A4 de forma que sus efectos tóxicos se pueden intensificar con el aporte de dicha isoemzima mediante otras vias como los antibioticos macrolidos e imidazolicos,antiretrovirales e inhibidores de la reductasa.
Los efectos secundarios de este fármaco estan directamente relacionados con la dosis.
- Sildenafilo
Reacciones adversas:
Ciertas:
- Alteración de la percepción del color
- Visión azulada de los objetos
- Visión borrosa central
- Escotomas centelleantes
- Hiperemia conjuntival.
- Fotofobia
- Alteraciones en el ERG.
Posibles:
- Hemorragia subconjuntival.
- Accidentes vasculares en retina.
Dudosas:
- Neuropatía isquémica.
Evolución: Los efectos adversos del fármaco relativos a la percepción anomala de colores y de la luz son reversibles en una horas sin secuelas de ningun tipo.
Dosis habitual: 25-100 mg/dia.
• AGENTES INMUNOSUPRESORES
Los inmunosupresores tienen un amplio campo de aplicación en enfermedades autinmunitarias y trasplantes de órganos donde se han demostrado como agentes de una gran eficacia terapeutica.Destacan tres grupos a)Glucorticoides,b)Inhibodores de la Calcineurina y c) Antiproliferantes y Antimetabolitos.Los Glucocorticoides son tratados en otro apartado de este capitulo.
En dependencia de su composición presentan un lugar de accion diferente a nivel de la cadena de los mecanismos inmunológicos:
Lugar de acción de los inmunosupresores.
|
Fármaco |
Acción |
|
Glucocorticoides Ciclosporina Tacrolimo Azatriopina Micofenolato de Mofetilo Daclizumad Sirolimo |
A nivel DNA regulando las transcripcion genica. Calcineurina inhibiendo la accion de las fosfatasas. Calcineurina inhibiendo la accion de las fosfatasas. Acido desoxirribonucleico incorporando un nucleotido falso. Inhibe la actividad de la Deshidrogenada de Inopina. Bloquea la activacion de linfocitos T al actuar sobre los receptores de la Interleuquina-2 Inhibe la activacion de la cinasa de proteína. |
- Ciclosporina A
Principalmente utlizado en la modulación inmunológica de trasplantes de órgano: Hígado, corazon, riñon o pulmón o en trasplante de tejido oseo, medular o corneal. Empleado en patología dermatologica, renal cardivascular, oftalmológica, etc. y en general en trastornos inmunologicos de diferente origen y características. En Oftalmología se utiliza en la terapia de uveitis, escleritis, trasplante de córnea y reacciones penfigoides entre otras.
Reacciones adversas:
- Disminución de vision.
- Ceguera cortical
- Alucinaciones.
- Queratitis. Conjuntivitis.
- Eritema parpebral. Urticaria.
- Alteraciones retinianitas:
Hemorragias.
Exudados algodonosos. - Edema papilar.Neuropatia óptica.
- Parálisis musculatura extrínseca.Nistagmus.
- Tricomegalia.
- Dolor ocular de origen no filiado.
Evolucion: Los efectos secundarios a la terapia con Ciclosporina son dificles de evaluar al tratarse de pacientes con otras medicaciones simultaneas y habitualmente con una efctación sistémica grave por su patología primitiva.El edema de papila óptica puede ser generado por la acción tóxica del fármaco directamente sobre las fibras nerviosas a traves de la alteración del flujo axoplásmico o por la Hipertensión Endocraneal. La mayoria de los efectos oculares desparecen con la discontinuidad del fármaco o con la disminucion de dosis o la supresión total.
Dosis habitual: 5 mg/kg/dia en dos dosis.
- Azatriopina
Reacciones adversas:
- Agrava infeccion hérpetica.
- Perdida de cejas y pestañas.
- Hemorragias secundarias a anemia.
- Accion teratogénica.
- Favorece infecciones conjuntivales.
Evolucion: Las reacciones adversas oculares de la Azatriopina son de escasa significación clínica y el numero de notificaciones al Registro Nacional es muy bajo y discutible en cuanto a la relacion causa-efecto del fármaco.Los síntomas señalados desparecen totalmente y de forma precoz en los casos notificados y solo se puede considrar perdurable la posible accion teratogénica. Los efectos secundarios sitemicos en administración de Azatriopina simultáneamente con otros fármacos pueden ser importantes destacando notificaciones de Leucoencefalopatia multifocal en varios pacientes.
Dosis habitual: 2.5 mg./kg/dia en dosis unica.
Índice de reacciones adversas por drogas sistémicas
Clasificación por patologías
Establecer un indice de reacciones adversas que recoga la totalidad de notificaciones recibidas supone señalar una lista de practicamente todos los fármacos sistémicos. El Registro Nacional de los EE UU recibe notificaciones de reacciones relacionadas con la mayoria de las las medicaciones comercializadas;algunas de ellas aparecen en casos clinicos aislados sin muchas posibilidadesn de correlación causa-efecto mientras que en otras la relación con el fármaco sospechoso ofrece el carácter de probable o cierta. Algunas de estas Notificaciones poseen carácter de reaccion probada.En este indice señalamos aquellas que se observan con mayor frecuencia con especial mención a las Reacciones Probadas.
Reacciones adversas en conjuntiva y párpados
| Fármaco | Reacción adversa |
|
A. Aminopropioico Amiodarona Cicloserina Ciprofloxacion Clorpromacina Etionamida Etritinato Isotretionina Mercaptopurina Metrotexate Niacina Rifampicina Sulfonamidas Tetraciclinas Tioguanina Sales de Oro |
Conjuntivitis. Dermatitis parpebral Pigmentación parpebral Eritema. Conjuntivitis Eritema. Conjuntivitis Pigmentación parp. Eritema parpebral. Conjuntivitis Ojo seco Blefaroconjuntivitis. Ojo seco Pigmentación Parpebral Depósitos. Ojo seco Edema conjuntival Pigmentación parpebral Edema parpebral. Quémosis conjuntival Quistes de inclusión en conjuntiva Pigmentación parpebral Depósitos* |
|
*Reaccion probada. |
|
Reacciones adversas en cristalino
| Fármaco | Reacción adversa |
|
Alupurinol Amiodarona Azatriopina Busulfan Clorpromacina Colchicina Corticoides Fenotiazidas Fluoroquinolona Metoxipsolarenos Sales de Oro Tetraciclinas |
Catarata* Catarata Catarata Catarata policroma Catarata. Pigmentación Catarata* Catarata subc.* Catarata. Depósitos* Catarata Depósitos. Catarata Depósitos* Catarata |
|
*Reaccion probada |
|
Alteraciones en la Musculatura Extrínseca
| Fármaco | Reacción adversa |
|
Antihistaminicos Barbitúrico Benzodiacepinas Carbamacepina Cloroquina Etanol Fenitoina Fenotiazidas Haloperidol Hipoglucemiantes Litio Mariuana Mefloquina Metanol Metoclorpramida Salicilatos Tioridazina Triciclitos Vincristina |
Nistagmus Nistagmus*. Parálisis* Diplopia Papiledema. Nistagmus Parálisis* Parálisis* Nistagmus. Parálisis Diplopia Crisis oculogiras Diplopia Nistagmus* Diplopia Diplopia Nistagmus* Crisis oculogiras Nistagmus Alt. Motilidad* Diplopia Parálisis |
|
*Reaccion probada. |
|
Alteraciones en esclera
| Fármaco | Reacción adversa |
|
Bifosfonatos |
Epiescleritis* |
|
*Reaccion probada. |
|
Reacciones adversas en retina
| Fármaco | Reacción adversa |
|
Anticonceptivos.* Antineoplásicos Barbituricos Carmustina Ciclofosfamida Cloranfenicol Cisplatino Clorambucil Clorpromazina Cloroquina. Hidroxic. Estrógenos Fenotiazidas Glucósidos cardiacos Hidroxicloroquina Indometacina Isotretinoina Mefloquina Mitomicina C Niacina Procarbacina Quinina Retinoide Salicilatos Talco l Tamoxifen Tioridazina |
Embolia a.central Maculopatia.Depósitos. Alteraciones vasculares Vasculitis retiniana Vasculitis* Depósitos Vasculitis.Alt en E.R.G Papildema* Depósitos Maculopatia.Pigmentación Embolia arteria c. de la retina Edema macular* Fenómenos entópticos* Maculopatía Hemorragias.Pigmentación Edema macular y retiniano Retinopatía Tóxica* Toxicidad retiniana Edema macular quistico Hemorragias retinianas Maculopatia.Depósitos* Edema macular Hemorragias. Oclusión arteria central Depositos en mácula* Pigmentación* |
|
*Reaccion probada. |
|
Alteraciones de la Refracción
| Fármaco | Reacción adversa |
|
Acetazolamida • Acetoxiexamida • Anticonceptivos • Clorpropamida • Corticoides • Glibumida • Glibenclamida • Hidroclorotiazida • Pirazolonas • Retinoides • Sulfonamidas • Toxacamida |
Miopía* Hipermetropia* Miopía* Hipermetropia* Miopía Hipermetropia* Hipermetropia* Miopía* Hipermetropia* Miopía* Miopía Hipermetropía* |
|
*Reaccion probada. |
|
Reacciones adversas en Nervio Optico.
| Fármaco | Reacción adversa |
|
Aminoglucósidos • Amitriptilina • Androgenos • Amiodarona • Anticonceptivos orales • Antinflamatorios no est. • Barbitúricos • Carbamacepina • Cisplatino • Clindamicina • Clorambucil • Cloranfenicol • Corticoides • Disulfiran • Etambutol • Etanol • Etuximida • Fenitoina • Hidantoinas • Isoniazida • Isotretionina • Litio • Rifampicina • Salicilatos • Tetraciclinas • Tamoxifen • Tobramicina |
Pseudotumor cerebri.Papiledema* Neuritis óptica* Papiledema Neuropatía Pseudotumor cerebri. Edema pap* Neuritis óptica Neuritis óptica* Papiledema* Neuritis. Papiledema.* Neuritis óptica Papiledema Neuritis* Papiledema* Neuritis* Neuritis retrobulbar* •Neuropatía* Diplopia.Nistagmus Edema papilar* Atrofia Optica* Neuritis óptica retrobulbar* Edema papilar Neuritis Neuropatía* Papiledema* Pseudotumor Cerebri.Papiledema Neuropatía* Atrofia Optica* |
|
*Reaccion probada. |
|
Reacciones adversas sobre la secrección lagrimal
| Hiposecreción | Hipersecrección |
|
A.Triciclitos* • Antihistaminicos.* • Ansioliticos. • Antazolina • Atropina • Betabloqueantes* • Cimetidina* • Diureticos • Escopolamina* • Fenotiacinas • Fluoxetina. • Fluvoxamina. • IMAO • Isotretinoina. • Niacina. • Psolarenos* • Retinol.* • Quinidina • Tiazidas |
Efedrina.* • Reserpina • Hidrazalina • Neostigmina • Pilocarpina* |
|
*Reaccion probada. |
|
Alteraciones pupilares
| Fármaco | Reacción adversa |
|
Antihistamínicos Atropina Belladona Benzodiacepinas Butiroprofenos Codeina Cocaina Fenotiazidas Disopiramida Haloperidol Levodopa LSD Loxapina Hashish Mariuana Mescaline Morfina Neoprostigmina Psilocibin Tricíclicos |
Midriasis* Midriasis* Midriasis* Midriasis* Midriasis Miosis* Midriasis* Midriasis* Midriasis •Midriasis* Midriasis Midriasis Midriasis* Miosis.Midriasis* Midriasis.Miosis* Midriasis Miosis* Miosis* Midriasis. Miosis Midriasis* |
Fármacos que producen Discromatopsias
|
Acido Nalidipsidico.* AINES* Amiodarona Anticonceptivos orales* Barbitúricos* Cloroquina* Disulfiran Digoxina Digitoxina Digital Estreptomicina* Etambutol* Indometacina* Isonacida* LSD/Psicolobin/Mescal Oubaina Sildenafilo* |
|
*Reaccion probada. |
|
Glaucoma |
|
Benzotropina Corticoides Diazepan Clorfeniramina Triciclitos Anfetamina Escopolamina Cordiazepoxidos |
|
Uveítis anterior |
|
Acetazolamida Sales de Oro Pradiloxina Opiaceos Iodos radiactivos Rifabutina |
|
Cornea Edema |
|
Amantadita Amodiaquina Anfotericina B Benzalkonium Ceflacor Cocaína Clorpromazina Clorhexidina Digitalices Mitomicina |
|
Córnea. Depósitos |
|
Amantadina Amiodarona* Benzodiacepinas Clorpromazina Cloroquina* Cocaína* Fenotiazidas Indometacina* Hidroxicloroquina Sales de Oro* Selegilina Tamoxifen* |
|
* Reacción probada. |
|
Ojo seco |
|
Antihistamínicos Anticolinérgicos Ciclofosfamida Diuréticos Fluoroacilo Metrotexate Retinoides orales |
Bibliografía
-
Abdollahi M, Shafiee A, Bathaiee FS, Sharifzadeh M, Nikfar S. Drug-Induced toxic J Infus Nurs. 2004 Dec;27(6):386-98.
-
Abou-Eisha A, Afifi M. Genotoxic evaluation of the antimalarial drug, fansidar, in cultured humanos lymfhocytcs. Cell Biol Toxicol.Sep, 20(5):303-11.
-
Abreu ME, Bigelow GE, Fleisher L, Walsh SL.Effect of intravenous injection speed on responses to cocaine and hydromorphone in humans. Psychopharmacology (Berl). 2001 Feb;154(1):76-84.
-
Abidi S.Bhaskara SM.From Chlorpromazine to clozapine-antipsychotic adverse effects and the clinicans dielma.Can J Psychiatry,2003 Dec;48(11);p.749.
-
Albay D, Adler SG, Philipose J, Calescibetta CC, Romansky SG, Cohen AH Chloroquine-induced lipidosis mimicking Fabri disease. Mod Pathol. 2004 Dec 17.
-
Akhondzadeh S, Tavakolian R, Davari-Ashtiani R, Arabgol F,Amini H. Selegiline in the treatment of attention deficit hyperactivity disorder in children: a double blind and randomized trial. Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 27, Issue 5, August 2003, Pages 841-845.
-
Akhondzadeh S, Tavakolian R, Davari-Ashtiani R, Arabgol F,Amini H. Effect of selegiline administration in age-associated memory impairment (AAMI) subjects.European Neuropsychopharmacology, Volume 5, Issue 3, September 1995, Page 382.
-
Amaral L, Kristiansen J.E.Phenothiazines: an alternative to conventional therapy for the initial management of suspected multidrug resistant tuberculosis. A call for studies.International Journal of Antimicrobial Agents, Volume 14, Issue 3, April 2000, Pages 173-176.
-
Ambekar C.S, Lee J S , Cheung B M ,Chan L C, Liang R, Kumana C R. Chloramphenicol succinate, a competitive substrate and inhibitor of succinate dehydrogenase: possible reason for its toxicity.Toxicology in Vitro, Volume 18, Issue 4, August 2004, Pages 441-447.
-
Araiza-Casillas R, Cardenas F, Morales Y, Cardiel MH. Factors associated with chloroquine-induced retinopathy in rheumatic diseases.Lupus. 2004;13(2):119-24.
-
Balacco Gabrieli C, Regine F, Vingolo EM, Rispoli E, Isidori A.Acute electroretinographic changes during sildenafil (Viagra) treatment for erectile dysfunction.Doc Ophthalmol. 2003 Sep;107(2):111-4.
-
Baltazis E M, S,Manollet R,Razzaque A,Foster S.The effect of treatment and its related side effects in patients with severe ocular cicatricial pemphigoid Ophthalmology, Volume 109, Issue 1, January 2002, Pages 111-118.
-
Banta JT,Hoffman K,Bundez DI.Presuned topiramato-induced bilateral acute angle-closure glaucoma.Am.J.Ophthalmology 2001;132:112-4.
-
Baños JE,March M.Farmacologia ocular.Edt.UPC. Barcelona.1994.
-
Barbon Garcia JJ, Alvarez Suarez ML, Alvarez Navascues R, Vina Escalar C, Guerediaga Madariaga J.Serous retinal detachment in systemic erithematosus lupus during corticosteroid therapy.Arch Soc Esp Oftalmol. 2004 Apr;79(4):177-80.
-
Barnett S,,and cols Tolerability of fluoxetine in posttraumatic stress disorder Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 26, Issue 2, February 2002, Pages 363-367.
-
Bayer A, Thiel HJ, Zrenner E, Paulus W, Ried S, Schmidt D. Sensitive physiologic perceptual tests for ocular side effects of drugs exemplified by various anticonvulsants. Ophthalmologe. 1995 Apr;92(2):182-90. German.
-
Beal MF.Amitriptylina ophthalmoplegia.Neurology 1982,32:1409.
-
Beharcohen M F, Dighiero P, Renard G. Lyell's syndrome and its ophthalmologic manifestations in Cameroon. J Fr Ophtalmol. 2000 Mar;23(3):229-37.
-
Beilin M, Neumann R, Belkin M, Green K, Bar-Ilan A. Pharmacology of the intraocular pressure (IOP) lowering effect of systemic dexanabinol (HU-211), a non-psychotropic cannabinoid. J Ocul Pharmacol Ther. 2000 Jun;16(3):217-30.
-
Beghi E.Efficacy and tolerability of the new antiepileptic drugs: comparison of two recent guidelines.Lancet Neurology - Vol. 3, Issue 10, October 2004, Pages 618-621.
-
Berman R M, Amit A, Cappiello A, Miller H, Hu S,Oren D. O, Charney D.S. The use of pindolol with fluoxetine in the treatment of major depression: final results from a double-blind, placebo-controlled trial .Biological Psychiatry, Volume 45, Issue 9, May 1999, Pages 1170-1177
-
Bhagat N, Read RW, Rao NA, Smith RE,Chon Chong LP.Rao NA, Smith RE,Chon Chong LP.Rifabutin-associated hypopyon uveitis in human immunodeficiency virus-negative immunocompetent individuals.Ophthalmology. 2001 Apr;108(4):750-2.
-
Bernstein H N: Ophthalmic considerations and testing in patients receiving long-term antimalarial therapy. Am J Med 75:25, 1983.
-
Bonnetblanc JM,Hugon J,Dumas M,Rupin D.Intracranial hypertension with etretinate .Lancet.1983;2(8356):974.
-
Breneman D,Bronsky E A, Bruce S, Kalivas J T, Klein GL, Roth R, Tharp M, Treger C, Soter N. Cetirizine and astemizole therapy for chronic idiopathic urticaria: A double-blind, placebo-controlled, comparative trial. Journal of the American Academy of Dermatology, Volume 33, Issue 2, Part 1, August 1995:192-198.
-
Buszman E; Rozanska R; Interaction of quinidine, disopyramide and metoprolol With melanin in vitro in relation to drug-induced ocular toxicity. Pharmazie; 2003 Jul; 58(7); p. 507-11.
-
Canning, CR, and Hague, S: Ocular quinine toxicity, Br J Ophthalmol 72:23-26, 1988.
-
Cardelús I,Antón F, Beleta J, Palacios JM.Anticholinergic effects of desloratadine, the major metabolite of loratadine, in rabbit and guinea-pig iris smooth muscle.European Journal of Pharmacology, Volume 374, Issue 2, 18 June 1999:249-254.
-
Carpay JA, Aldenkamp AP, van Donselaar CA. Complaints associated with the use of antiepileptic drugs: results from a community-based study..Seizure. 2005 Apr;14(3):198-206.
-
Chaouloff F, Durand M,Mormède P.Anxiety- and activity-related effects of diazepam and chlordiazepoxide in the rat light/dark and dark/light tests . Behavioural Brain Research, Volume 85, Issue 1, April 1997, Pages 27-35.
-
Chen YF,Avery AJ,Neil KE,Johnson C,Dewey ME,Stockley IH.Incidence and possible causes of prescribing potentially hazardous/contraindicated drug .combinations in general practice.Drug Saf.2005;28(1):67-80.
-
Cohen R.S.Subjective reports on the effects of the MDMA (‘ecstasy’) experience in humans . Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 19, Issue 7, November 1995, Pages 1137-1145.
-
Coleman Ch C., King B R,, Bolden-Watson C, Book M J, Taylor Segraves T, Richard Ascher N.O., Batey S, Jamerson B,Metz A.A placebo-controlled comparison of the effects on sexual functioning of bupropion sustained release and fluoxetine .Clinical Therapeutics, Volume 23, Issue 7, July 2001, Pages 1040-1058.
-
Dangelmaier S, Weindler J, Ruprecht KW. Drug side-effects of the eye--a contribution to quality assurance in ophthalmology. Klin Monatsbl Augenheilkd. 1996 May;208(5):385-8.
-
Danish University Antidepressant Group (DUAG) Clomipramine dose-effect study in patients with depression: Clinical end points and pharmacokinetics.Clinical Pharmacology & Therapeutics, Volume 66, Issue 2, August 1999, Pages 152-165.
-
David S, Taylor C, Kinon B, Breier A.The Effects of Olanzapine, Risperidone, and Haloperidol on Plasma Prolactin Levels in Patients with Schizophrenia .Clinical Therapeutics, Volume 22, Issue 9, September 2000, Pages 1085-1096.
-
Davis GJ, McKenzie BE. Toxicologic evaluation of ofloxacin. Am J Med. 1989 Dec 29;87(6C):43S-46S.
-
De S Meyer P,Crisp AJ.Pamidronato and uveitis.Br.J.Hematol 1995;34(5):479.
-
De Tommaso AM, Santos DS, Novaes P, Arieta CE, Hessel G. Steroid-induced cataracts in patients with autoimmune hepatitis.Acta Gastroenterol Latinoam. 2003;33(2):93-7.
-
Dendooven L, P. Splatt P,Anderson J M.The use of chloramphenicol in the study of the denitrification process: Some side-effects.Soil Biology and Biochemistry, Volume 26, Issue 7, July 1994, Pages 925-927.
-
Desoize B,Marechas F,Millart H ,Cattan A.Correlation of clinical pharmacokinetic parameters of cisplatin with efficacy and toxicity. Biomedecine & Pharmacotherapy, Volume 45, Issues 4-5, 1991, Pages 203-207.
-
Domingues MF,Barros H,Falcao-Reis FM.Amiodarona and optic neuropathy.Acta .Ophthalmol Scand.2004 Jun;82:277-82.
-
Douglas M. , Charles F, Zukoski M, Ogden D A.Massive azathioprine overdose : Case report and review of the literature. The American Journal of Medicine, Volume 56, Issue 1, January 1974, Pages 133-136.
-
Dridi D, Attia M.B,Reinberg A, Boughattas N.A..Rythmes circadiens des effets toxiques d'un antihistaminique H1 : la cétirizine chez la souris. Pathologie Biologie, In Press, Corrected Proof, Available online 12 August 2004.
-
Dylag T, Zygmunt M, Maciag D, Handzlik J, Bednarski M, Filipek B, Kiec-Kononowicz K. Synthesis and evaluation of in vivo activity of diphenylhydantoin basic derivatives. Eur J Med Chem. 2004 Dec;39(12):1013-27.
-
Easterbrook, M, and Bernstein, H:Ophthalmic monitoring of patients taking antimaterials: preferred practice patterns, J Rheumatol 24:1930-1932, 1997.
-
Eisner A,Austin DF,Samples JR.Short wavelength automated perimetry and tamoxifen use.Br J Ophthalmol 2004;88:125-130.
-
Esser J, Brandt T. [Pharmacologically-caused eye movement disorders--differential diagnosis and mechanisms of action] Fortschr Neurol Psychiatr. 1983 Feb;51(2):41-56.
-
Falcone, PM, Paolini, L, and Lou, Pl: Hydroxychloroquine toxicity Despite normal dose therapy, Ann Ophthalmol 25:385-388, 1993.
-
Farkas S, Berzsenyi P, Kárpáti E, Kocsis P,Tarnawa I.Simple pharmacological test battery to assess efficacy and side effect profile of centrally acting muscle relaxant drugs. Journal of Pharmacological and Toxicological Methods, In Press, Corrected Proof, Available online 12 January 2005.
-
Fernandes N, Ralston R. Martin R.Schenker S.Trazodone-induced hepatotoxicity: a case report with comments on drug-induced hepatotoxicity.The American Journal of Gastroenterology, Volume 95, Issue 2, February 2000, Pages 532-535.
-
Fernandez Alfonso Mª S,Ruiz Gallo M.Fundamentos de Farmacologia basica y clinica.Editorial Universitaria Ramon Areces.Madrid.2005.
-
Filovska V ,Jakovcevska-Kujundziska M, Lazarova M , Krsteska R.P.6.080 Long-term exposure to lithium therapy and side effects with common dosing.European Neuropsychopharmacology, Volume 13, Supplement 4, October 2003, Pages S459-S460.
-
Finbloom, DS, Silver, K, Newsome, DA, and Gunkel, R: Comparison Of hydroxychloroquine and chloroquine use and the development of Retinal toxicity, J Rheumatol 12:692-694,1985.
-
Flach, AJ., Dolan, B.J. Progression of amiodarone induced cataracts. Doc. Ophthalmol., 83, 323-329 (1993).
-
Fornaro P, Mungo S, Lunetta A.M.Opthalmological side effects of psychotropic agents .Biological Psychiatry, Volume 42, Issue 1, Supplement 1, 1 July 1997, Page 161S.
-
Fox W,Robinson D.K, Tall R, D. . Mitchison A , Kent PW,MacFadyen M. A study of acute intolerance to ethionamide, including a comparison with prothionamide, and of the influence of a vitamin B-complex additive in prophylaxis .Tubercle, Volume 50, Issue 2, June 1969, 125-143.
-
Frank IM, Ung Hepler erleider JT. Pu RS pupilary constritionafter marijuana smoking. Am J Ophthalmol. 1972 Dec;74(6):1185-90.
-
Fraunfelder FT,Farunfelder FW,Randall JA.Drug Induced Ocular Side Effects.5ª edcc.Boston:Butterworth-Heinnemann;2001:482-4.
-
Fraunfelder F.T,Fraunfelder F.W.Drug-Induced Ocular Side effects.Edit.Butterworth-Heinemann.2001.
-
Fraunfelder F.T,Fraunfelder FW,Edwards R.Ocular side effects possibly associated with isotretionin usage.Am.J.Ophthalmol 2001;132:299-305.
-
Fraunfelder F W,Fraunfelder F T.Biphosphonatos and ocular inflammation(letter).N Engl J Med 2003 ;348:1187-8.
-
Fraunfelder FW, Fraunfelder FT, Jensvold B.Scleritis and other ocular side effects associated with pamidronate disodium.Am.j.Ophthalmol 2003;135:219-22.
-
Fraunfelder F.W. Rich L.Possible adverse effects of drugs used in refractive surgery .Journal of Cataract & Refractive Surgery, Volume 29, Issue 1, January 2003, Pages 170-175.
-
Fraunfelder FW,Fraunfelder FT.Reacciones farmacologicas recientemente identificadas en el Registro Nacional de Efectos Secundarios Oculares Inducidos por Farmacos.Ophthalmology 2004;Ed Esp.Oct.Vol 1,nº5:312-17.
-
Fraunfelder FW,Fraunfelder FT,Reates EU.Topiramato associated acute bilateral secundary angle-closure glaucoma.Ophthalmology 2004;111:109-11.
-
Fraunfelder FW.Ocular side effects associated with biphosphonates.Drugs Today 2003;39:829-35.
-
Fraunfelder F.W,Fraunfelder F.T.Adverse ocular drug reactions recently identified by the National Registry of Drug-Induced Ocular Side effects. Ophthalmology, Volume 111, Issue 7, July 2004:1275-1279.
-
Fraunfelder F.W, Fraunfelder F.T..Oculogyric crisis in patients taking cetirizine.American Journal of Ophthalmology, Volume 137, Issue 2, February 2004: 355-357.
-
Fraunfelder FW,Fraunfelder FT,Corbett JJ.Isotretinoin-Associated Intracranial Hypertension.Ophthalmology 2004,111(6):1248-1250.
-
Frazer A.Mechanisms of action of antidepressants.European Neuropsychopharmacology, Volume 7, Supplement 2, September 1997, Page S149
-
Frey H.H. Bartels I..Felbamate and meprobamate: a comparison of their anticonvulsant properties Epilepsy Research, Volume 27, Issue 3, June 1997, Pages 151-164.
-
Friedland MD.Proptosis y edema periorbitario debido al tratamiento con Diltiazen.Archives of Ophthalmology.Ed.Española.1994.Vol 5 .nº1.28-9.
-
Garcia M,Sanz E,Serrano M A,Cordoves L,Kalitovics N.Reacciones adversas en Oftalmologia.Edit:Allergan S.A.1996.
-
Gelmann EP. Tamoxifen for the treatment of malignancies other than breast and endometrial carcinoma. Semin Oncol ,1997;24:65–70.
-
Gigantelli JW, Braddock SR, Johnson LN. Complaints associated with the use of antiepileptic drugs: results from a community-based study.Seizure. 2005 Apr;14(3):198-206.
-
Glover SJ, Quinn AG, Barter P, Hart J, Moore SJ, Dean JC, Turnpenny PD. Ophthalmic Findings in fetal anticonvulsant syndrome(s).Ophthalmology. 2002 May;109(5):942-7.
-
Giuri S.Neosynephrine mydriasis combined with general anesthesia with halothane in ocular surgery.Oftalmologia. 2002;52(1):97-100.
-
Godel,V.,Nemet,P.,Lazar M:Chloramphenicol optic europathy.Arch.Ophthalmol.98:1417,1980.
-
Goodman y Gilman.Las bases farmacologicas de la terapeutica.Interamericana Editores.Ediccion española.2002.
-
Gorin MB, Day R, Costantino JP, et al. Long-term tamoxifencitrate use and potential ocular toxicity. Am J Ophthalmol1998;125:493–501.
-
Govier F, Potempa AJ, Kaufman J, Denne J, Kovalenko P, Ahuja S. A multicenter, randomized, double-blind, crossover study of patient preference for tadalafil 20 mg or sildenafil citrate 50 mg during initiation of treatment for erectile dysfunction.Clin Ther. 2003 Nov;25(11):2709-23.
-
Green K, Sobel R E, Fineberg E, Wynn HR, Bowman KA.Subchronic ocular and systemic toxicity of topically applied delta 9-tetrahydrocannabinol.Ann Ophthalmol. 1981 Oct;13(10):1219-22.
-
Green K.Marijuana and eye:a review.J Toxicol Cut Ocular Toxicol1982:1:13.
-
Grenier E, Kirby J.Chlorpromazine: Case report and review of its ocular side-effects Clinical Eye and Vision Care, Volume 10, Issue 2, 1 June 1998, Pages 73-79 .
-
Grierson, DJ: Hydroxychloroquine and visual screening in anrheumatology outpatient clinic, Ann Rheum Dis 56:188-190, 1997.
-
Grunwald J E, Siu K K, Jacob S ,Dupont J.Effect of sildenafil citrate (viagra) on the ocular circulation .American Journal of Ophthalmology, Volume 131, Issue 6, June 2001, Pages 751-755.
-
Haffmans P.M.,. Vos M.S.The effects of trazodone on sleep disturbances induced by brofaromine .European Psychiatry, Volume 14, Issue 3, June 1999, Pages 167-171 .
-
Hajnal BL, Ferriero DM, Partridge JC, Dempsey DA, Good WV.Is exposure to cocaine or cigarette smoke during pregnancy associated with infant visual abnormalities?Dev Med Child Neurol. 2004 Aug;46(8):520-5.
-
Hamed L.M.et al..Pseudotumor cerebri induced by danazol Am.J.ophthalmol.1989;107(2):105-110.
-
Hamideh F, Prete P E.Ophthalmologic manifestations of rheumatic diseases.Seminars in Arthritis and Rheumatism, Volume 30, Issue 4, February 2001, Pages 217-241.
-
Hampton GR, Krepostman JI. Ocular manifestations of the fetal hydantoin syndrome.Clin Pediatr (Phila). 1981 Jul;20(7):475-8.
-
Hartnell NR, Wilson JP.Replication of the Weber effect using postmarketing adverse event reports voluntarily submitted to the United States Food and Drug Administration.Pharmacotherapy. 2004 Jun;24(6):743-9.
-
Hayreh S S.Effect of sildenafil citrate (viagra) on the ocular circulation .Am.J. of Ophthalmology, Volume 133, Issue 1, January 2002, Pages 169-170 .
-
Heier JS, Dragoo RA, Enzenauer RW, Waterhouse WJ.Screening for ocular toxicity in asymptomatic patients treated with tamoxifen. Am J Ophthalmol 1991;117:772–775.
-
Heier JS, Dragoo RA, Enzenauer RW, Waterhouse WJ. Screening for ocular toxicity in asymptomatic patients treated with tamoxifen. Am J Ophthalmol 1994;117:772-775.
-
Hwang WJ, Tsai JJ. Acute phenytoin intoxication: causes, symptoms, misdiagnoses, and outcomes.Kaohsiung J Med Sci. 2004 Dec;20(12):580-5.
-
Herchline TE.Ocular ethambutol toxicity. Mayo Clin Proc; 2004 May; 79(5); 701; author reply 701.
-
Hollan S, Vecsei L, Magyar K. Adverse effects of dopamine potentiation by long-term treatment with selegiline.Mov Disord. 2004 Jan;19(1):107-9.
-
Holekamp NM, Thomas MA, Pearson A. The safety profile of long-term, high-dose intraocular corticosteroid delivery.Am J Ophthalmol. 2005 Mar;139(3):421-8.
-
Hollander DA, Aldave AJ Drug-induced corneal complications. Curr Opin Ophthalmol.2004 Dec; 15(6):541-8. Review.
-
Imperia PS, Lazarus H.M.,Lass J.Ocular complications of systemic cancer chemotherapy.Survey of Ophthalmology, Volume 34, Issue 3, November-December 1989, Pages 209-230.
-
Jagle H, Jagle C, Serey L, Yu A, Rilk A, Sadowski B, Besch D, Zrenner E, Sharpe LT. Visual short-term effects of Viagra: double-blind study in healthy young subjects.Am J Ophthalmol. 2004 May;137(5):842-9.
-
Järvinen T, Pate D W, Laine K.Cannabinoids in the treatment of glaucoma.Pharmacology & Therapeutics, Volume 95, Issue 2, August 2002, Pages 203- 2200.
-
Jhung JW. Chloroquine enchances survival in Bacillus anthracis intoxication. J Infect Dis. 2004 Nov 1;190(9): 1655-60. Epub 2004 Sep 28.
-
Jocalyn Clark .Medical Journal (International edition). London: Nov 23, 2002. Tomo 325, No. 7374; pág. 1248.
-
Jumbelic MI, Hanzlick R, Cohle S.Alkylamine antihistamine toxicity and review of Pediatric Toxicology Registry of the National Association of Medical Examiners. Report 4: Alkylamines.Am J Forensic Med Pathol. 1997 Mar;18(1):65-9.
-
Kaiser–Kupfer MI, Kupfer C, Rodrigues MM. Tamoxifen retinopathy. A clinicopathologic report. Ophthalmology 1981;88:89 –93.
-
Kamei Mizumoto Y,Takehana M.The relathionship between properties of antipsychotic drugs cataract formation.Biol Pharma Bull.1994 Feb;17(2):237-42.
-
Klockgether T, Dichgans J. Visual control of arm movement in Parkinson's disease.Mov Disord. 1994 Jan;9(1):48-56.
-
König W,Heinrich T,Diehl B.A double-blind comparison of amitriptylinoxide versus doxepine in the treatment of severe depression. Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 18, Issue 3, May 1994 : 491-496.
-
Kosten T, Kosten T.A.New medication strategies for comorbid substance use and bipolar affective disorders Biological Psychiatry, Volume 56, Issue 10, 15 November 2004, Pages 771-777.
-
Koyama M, Mizota A, Igarashi Y, Adachi-Usami E.Seventeen cases of central serous chorioretinopathy associated with systemic corticosteroid therapy.Ophthalmologica. 2004 Mar-Apr;218(2):107-10.
-
Kurtulan E, Gulcu A, Secil M, Celebi I, Aslan G, Esen AA. Effects of sildenafil on ocular perfusion demonstrated by color Doppler ultrasonography. Int J Impot Res. 2004 Jun;16(3):244-8.
-
Lahti A.C.Holcomb H, Weiler M.A. Medoff D, Tamminga C.A.Functional effects of antipsychotic drugs: comparing clozapine with haloperidol . Biological Psychiatry, Volume 53, Issue 7, 1 April 2003, Pages 601-608.
-
Lazzaroni F, Scorolli L, Pizzoleo CF, et al. Tamoxifen retinopathy: does it really exist? Graefes Arch Clin Exp Ophthalmol. 1998;236:669-673.
-
Lee KC; Finley R; Miller B; Apraxia of lid opening: dose-dependent response to carbidopa-levodopa. Pharmacotherapy; 2004 Mar; 24(3); p. 401-3.
-
Lehrman G, Hogue IB, Palmer S, Jennings C, Spina CA, Wiegand A, Landay AL, Coombs RW, Richman DD, Mellors JW, Coffin JM, Bosch RJ, Margolis Depletion of latent HIV-1 infection in vivo: a proof-of-concept study, The Lancet - Vol. 366, 9485, 13 August 2005:549-555.
-
Lees A.W.Ethionamide 1,000 mG. and isoniazid 400 mG. in previously untreated cases of pulmonary tuberculosis.British Journal of Diseases of the Chest, Volume 59, Issue 4, October 1965, Pages 228-232.
-
Lopez L, Thomson A, Rabinowicz AL. Assessment of colour vision in epileptic patients exposed to single-drug therapy.Eur Neurol. 1999;41(4):201-5.
-
Lulin M, Yantang L.Comparison of the immunosuppressive and toxic effects of tii and azathioprine . Transplantation Proceedings, Volume 30, Issue 7, November 1998, Pages 3517-3518.
-
Llados JR.Efectos oculares de los tratamientos sistemicos.El Farmaceutico 2001;262:62-75.
-
Macarol V,Fraunfelder F W,Fraunfelder F T.Pamironato disodium and possible ocular adverse drug reactions. Am. J. Ophthalmol. 1994: 118:220-4.
-
McKinney PE, Phillips S, Gomez HF, Brent J, MacIntyre M, Watson WA.Vitreous humor cocaine and metabolite concentrations: do postmortem specimens reflect blood levels at the time of death?J Forensic Sci. 1995 Jan;40(1):102-7.
-
Macleod J, Oakes R, Copello A, Crom I, et al. Psychological and social sequelae of cannabis and other illicit drug use by young people: a systematic review of longitudinal, general population studies.The Lancet. London: May 15, 2004. Tomo 363, No. 9421; pág. 1579-89.
-
Maham Y,Mather A E.Surface thermodynamics of aqueous solutions of alkylethanolamines.Fluid Phase Equilibria, Volume 182, Issues 1-2, 5 June 2001: 325-336.
-
Marmor MF, Kessler R.Sildenafil (Viagra) and Ophthalmology . Survey of Ophthalmology, Volume 44, Issue 2, 10 September 1999, Pages 153-162.
-
Mbekeani JN,Slamovits TL,Schwartz BH,Sauder HL.Ocular inflammation associated with alendronate therapy.Arch Ophthalmol 1999;117:837-8 7.
-
Sirisb ES.Biphosphonatos and iritis.Lancet 1993;341:436-437.
-
Melamud A; Kosmorsky GS; Lee MS; Ocular ethambutol toxicity. Mayo Clin Proc; 2003 Nov; 78(11); p. 1409.
-
Mendez-Armenta M, Barroso-Moguel R, Villeda-Hernandez J, Romero-Diaz V, Rios C.Retinal lesions in rat fetuses prenatally exposed to cocaine.Neurotoxicol Teratol. 1997 May-Jun;19(3):199-203.
-
Metelitsina T,Grunwald J E, DuPont J C,Ying G.Effect of Viagra on the foveolar choroidal circulation of AMD patients .Experimental Eye Research, In Press, Corrected Proof, Available online 3 March 2005.
-
Moorthy RS, Valluri S.Ocular toxicity associated with systemic drug therapy. Curr Opin Ophthalmol. 1999 Dec;10(6):438-46.
-
Montague L, Vogel Ch, Ferguson J, Krasnow S, Saiers J , Hamm J, Salva K , Wiernik P H , Holroyde C P , Hammill S et al.Dronabinol and prochlorperazine in combination for treatment of cancer chemotherapy-induced nausea and vomiting Journal of Pain and Symptom Management, Volume 6, Issue 6, August 1991, Pages 352-359.
-
Mori A, Noda Y, Taku Nagai, Mamiya T, Furukawa H, Nabeshima T.Involvement of dopaminergic system in the nucleus accumbens in the discriminative stimulus effects of phencyclidine.Neuropharmacology, Volume 42, Issue 6, May 2002, Pages 764-771.
-
Nagra PK,Foroozan R,Savino PJ,Castillo J,Sergott RC.Amiodarona induced optic neuropathy.Br J Ophthalmol.2003 Apr;87(4):420-2.
-
Nordt S P, Clark R F.Midazolam: A review of therapeutic uses and toxicity Journal of Emergency Medicine, Volume 15, Issue 3, May-June 1997, Pages 357-365.
-
Noureddin BN, Seoud M, Bashshur Z, et al. Ocular toxicity in low-dose tamoxifen: a prospective study. Eye. 1999;13:729-733.
-
O’Brien, K W. Neff, C. B, Rajender R, Bergasa N, Regev A, Molina E, Amaro R, Rodriguez M, Chase VE, Lennox J.,Schiff .Preliminary Guy observation with dronabinol in patients with intractable pruritus secondary to cholestatic liver disease.The American Journal of Gastroenterology, Volume 97, Issue 8, August 2002, Pages 2117-2119.
-
Ouattara A, Landi M, Le Manach Y, Lecomte P, Leguen M, ,Comparative cardiac effects of terlipressin, vasopressin, and norepinephrine on an isolated perfused rabbit heart.Anesthesiology. 2005 Jan;102(1):85-92.
-
PalmerKJ,Holliday SM,Brogden RN.Mefloquine:A review of its antimalrial Activity,pharmacokinetic properties and therapeutic efficacy.Drugs 1993; 45(3):430-475.
-
Parrott A,Ecstasy C.Mood Effects in Recreational Polydrug Users. European Neuropsychopharmacology, Volume 6, Supplement 3, June 1996, Page 45.
-
Pavlidis NA, Petris C, Briassoulis E, et al. Clear evidencethat long-tern, low-dose tamoxifen treatment can induce ocular toxicity: a prospective study of 63 patients. Cancer. 1992;69:2941-2944.
-
Peters CN, Pohlmann-Eden B. Intravenous valproate as an innovative therapy in seizure emergency situations including status epilepticus-experience in 102 adult patients.Seizure. 2005 Apr;14(3):164-9.
-
Pugesgaard T, Von Eyben FE. Bilateral optic neuritis evolved during tamoxifen treatment. Cancer 1986;58:383–386.
-
Peters CN, Pohlmann-Eden B. Intravenous valproate as an innovative therapy in seizure emergency situations including status epilepticus-experience in 102 adult patients.Seizure. 2005 Apr;14(3):164-9.
-
Rao NA, Smith RE,Chon Chong LP.Rifabutin-associated hypopyon uveitis in human immunodeficiency virus-negative immunocompetent individuals.Ophthalmology. 2001 Apr;108(4):750-2.
-
Raymond E.Chemoprotectors, mechanisms of action and clinical applications .La Revue de Médecine Interne, Volume 17, Issue 11, November 1996, Pages 936-944.
-
Reingardiene DI,Azaravichiene AP,Vashkeliene II.Amiodarona-induce keratopathy.Kardiologiia 2003.43(5):56-9.
-
Remick R.A.Anticholinergic side effects of tricyclic antidepressants and their management • Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 12, Issues 2-3, 1988, Pages 225-231.
-
Rhee DJ,Goldberg MJ,Parrish RK.Bilateral angle-closure glaucoma and ciliary body swelling from topiramato.Arch Ophthalmol 2001; 119: 1721-3.
-
Robertson C R et al.Hallucinations after penicillin injection.Am.J.Dis Child.1985.139-1074.
-
Roffn Hilton E,Hosking S,Betts T.The effect of antiepileptic drugs on visual performance .Seizure, Volume 13, Issue 2, March 2004, Pages 113-128.
-
Routy JP.Valproic acid: a potential role in treating latent HIV infection The Lancet - Vol. 366, Issue 9485, 13 August 2005, Pages 523-524.
-
Rouveix B.Antibiotic Safety Assessment.International Journal of Antimicrobial Agents, Volume 21, Issue 3, March 2003, Pages 215-221.
-
Salamon S M.Tetracyclines in ophthalmology.Survey of Ophthalmology, Volume 29, Issue 4, January-February 1985: 239-264 .
-
Salmun L.M., Gates D, Scharf M, Greiding L, Ramon R,Heithoff K.Loratadine Versus Cetirizine: Assessment of Somnolence and Motivation During the Workday.Clinical Therapeutics, Volume 22, Issue 5, May 2000:573-582.
-
Sandyk R. Total external ophthalmoplegia induced by phenytoin. A case report.S Afr Med J. 1984 Jan 28;65(4):141-2.
-
Sano F,Tsuji K,Kunika N.Pseudotumor cerebri in a patient with acute promyelocitic leukemia during treatment whith all-trans-retinoic acid.Intern Med 1998;546-9.
-
Sano et al.Pseudotumor cerebri in a Patient with Acute Promyelocitic Leucemia during Treatment with All-Trans Retinoic Acid.Internal Medicine 1998,37(6):546-549.
-
Schroeter T,Lanvers C,Herding H,Suttorp M.Pseudotumor cerebri induced by all-trans-retinoic acid in a child treated for acute promyelocytic leukaemia.Med Pediatr Oncol 2000;34:284-6.
-
Sharma T, Shah N, Rao M, Gopal L, Shanmugam MP, Gopalakrishnan M, Bhende P, Bhende M, Shetty N.Sand, Baluswamy S.Visual outcome after discontinuation of corticosteroids in atypical severe central serous chorioretinopathy.Ophthalmology, Volume 111, Issue 9, September 2004, Pages 1708-1714.
-
Sauvage M.F., Rousseau A, Marquet P, Dumeirain F, Raby C, Lachâtre G. In Vitro and in Vivo Study of the Antithyroid Side Effects of Trimeprazine. Toxicology and Applied Pharmacology, Volume 158, Issue 2, 15 July 1999, Pages 125-131.
-
Sechter D, Troy S, Paternetti S,Boyer P.A double-blind comparison of sertraline and fluoxetine in the treatment of major depressive episode in outpatients.European Psychiatry, Volume 14, Issue 1, March 1999, Pages 41-48.
-
Schiepers O, Marieke C. Wichers M,Maes M.Cytokines and major depression .Progress in Neuro-Psychopharmacology and Biological Psychiatry, Volume 29, Issue 2, February 2005, Pages 201-217.
-
Schmidt D.Amiodarona treatment and visual prognosis.Klin Monastsbl Augenheilkd .2003 Nov ;220(11):744-86
-
Segawa K,Shimura T.Effect of dealumination of mordenite by acid leaching for selective synthesis of ethylenediamine from ethanolamine. Applied Catalysis A: General, Volumes 194-195, 13 March 2000:309-317.
-
Shaikh S.Retinal evaluation of pacients on chonic therapy amiodarona.Retina.2003 Jun;23(3):354-359.
-
Singh M, Shah GL. Teratogenic effects of phenytoin on chick embryos.Teratology. 1989 Nov;40(5):453-8.
-
Scuderi AC; Paladino GM; Marino C; Trombetta F In vitro toxicity of netilmicin and ofloxacin on corneal epithelial cells.Cornea; 2003 Jul; 22(5); p. 468-72.
-
Silva-Araujo A, Tavares MA, Patacao MH, Carolino RM. Retinal hemorrhages associated with in utero exposure to cocaine. Experimental and clinical findings. Retina. 1996;16(5):411-8.
-
Silva-Araujo A, Abreu-Dias P, Silva MC, Tavares MA.Effects of prenatal cocaine exposure in the photoreceptor cells of the rat retina.Mol Neurobiol. 1995 Aug-Dec;11(1-3):77-86.
-
Smith JA, Mueller BU, Nussenblatt RB, Whitcup Corneal endothelial deposits in children positive for human immunodeficiency virus receiving rifabutin prophylaxis for Mycobacterium avium complex bacteremia.Am J Ophthalmol. 1999 Feb;127(2):164-9.
-
Somner A.R. ,Selkon J B,Walton M, White A.B.Drug resistant pulmonary tuberculosis treated with ethambutol and rifampicin in north east England.Tubercle, Volume 52, Issue 4, December 1971, Pages 266-275.
-
Stanford J A, Currier T.D, Gerhardt G.A.Acute locomotor effects of fluoxetine, sertraline, and nomifensine in young versus aged Fischer 344 rats • ARTICLE Pharmacology Biochemistry and Behavior, Volume 71, Issues 1-2, January-February 2002, Pages 325-332.
-
Stewart GO, Stuckey BG, Ward LC.Iritis following intravenous pamidronate.Aust NZ Ned 1996;26(3):414-415.
Struck HG, Giessler S, Giessler C.Effect of non-steroidal anti-inflammatory drugs on inflammatory reaction. An animal experiment study.Ophthalmologe. 1995 Dec;92(6):849-53.
-
Tang R, Shields J, Schiffman J, et al. Retinal changes associated with tamoxifen treatment for breast cancer. Eye. 1997;11:295-297.
-
Taylor E.Psychopharmacology of impulsivity and aggression in childhood and adolescence .European Neuropsychopharmacology, Volume 7, Supplement 2, September 1997:131-132.
-
Taylor E.Psychopharmacology of impulsivity and aggression in childhood and adolescence .European Neuropsychopharmacology, Volume 7, Supplement 2, September 1997:131-132.
-
Thakral A, Shenoy R, Deleu D. Acute visual dysfunction following phenytoin-induced toxicity.Acta Neurol Belg. 2003 Dec;103(4):218-20.
-
Thambi L,Kapcala LP,Chambers W.Topiramate-associated secondary angle-closure glaucoma:a case series(letter).Arch Ophthalmol 2002;120:1108.
-
Tiamkao S,Sirijirachai C,Pseudotumor cerebri by all-trans-retinoic acid a case report.J Med Assoc Thai 2000;83:1420-3.
-
Vatansever HS, Kayikcioglu O, Gumus B.Histopathologic effect of chronic use of sildenafil citrate on the choroid & retina in male rats.Indian J Med Res. 2003 May;117:211-5.
-
Viraben R,Mathieu C,Fontan B.Benign intracranial hypertension during etretinate therapy for mycosis fungoides(letter). J Am Acad Dermatol 1985 ;13 :515-7.
-
Vizel,M,Oster ,M.W..:Ocular side effects of cancer chemoterapy.Cancer 49:1999,182.
-
Wadenberg M-L, Sills T L, Fletcher P.J, Kapur S.Antipsychoticlike effects of amoxapine, without catalepsy, using the prepulse inhibition of the acoustic startle reflex test in rats .Biological Psychiatry, Volume 47, Issue 7, 1 April 2000, Pages 670-676.
-
Walter S,Diaper C,Bowman R:Lack of evidence for systemic toxicity following topical chloranphenicol use.Eye.12:875-879,1998.
-
Welch D, Ousler GW 3rd, Nally LA, Abelson MB, Wilcox A.Ocular ying associated with oral antihistamines (loratadine) in the normal population-an evaluation of exaggerated dose effect. Adv Exp Med Biol. 2002;506(Pt B):1051-5.
-
Wilhelmus KR, Gilbert ML, Osato MS. Tobramycin in ophthalmology.Surv Ophthalmol. 1987 Sep-Oct;32(2):111-22.
-
Williams H, Zutshi D, Mushin A.Ophthalmic screening of patients receiving ketoprofen or flurbiprofen medication for inflammatory and degenerative joint diseases.Scand J Rheumatol Suppl. 1976;1976(0):85-92.
-
Winsberg B.G., Klee S, Pollack J.Effectiveness of pemoline among hyperkinetic children who fail to respond to methylphenidate.European Neuropsychopharmacology, Volume 6, Supplement 4, September 1996:4.
-
Wolfl M.E., Mosnaim A.D.Cutaneous and ocular side effects with chlorpromazine therapy .Biological Psychiatry, Volume 35, Issue 9, 1 May 1994, Page 743.
-
Yen MY, Wang AG, Chiang SC, Liu JH.Ethambutol retinal toxicity: an electrophysiologic study.J Formos Med Assoc. 2000 Aug;99(8):630-4.