Bevacizumab intravítreo en el tratamiento del edema macular secundario a oclusión de rama venosa de la retina
Dres. S. Figueroa M1, Arruabarrena C2, Noval S2, Contreras I3
1 Hospital Universitario Ramón y Cajal. Vissum. Madrid.
2 Vissum. Madrid.
3 Hospital Universitario Ramón y Cajal. Madrid.
Introducción
La obstrucción de rama venosa de la retina (ORVR) es una enfermedad vascular retiniana frecuente. Aparece entre la quinta y la séptima décadas de la vida y cursa con hemorragias intraretinianas sectoriales, exudados, edema macular (EM) e isquemia. En sus forma más severa puede evolucionar a una retinopatía proliferativa con hemorragias vítreas, glaucoma neovascular y retinopatía traccional (1,2).
El EM en la ORVR es la causa más frecuente de pérdida visual. Se han ensayado múltiples tratamientos médicos y quirúrgicos sin resultados satisfactorios ni definitivos. Clásicamente se establecía un período de observación de 3 meses en espera de una mejoría espontánea. Si pasados los tres primeros meses persistía una agudeza visual (AV) igual o inferior a 20/40 se realizaba una angiografía (AGF) para clasificar el EM en isquémico o no isquémico y con ello determinar el pronóstico visual. El edema isquémico tiende a la resolución espontánea con mejoría de AV. En el edema no isquémico sólo hay mejoría de AV en el 30% de los casos (3).
La fotocoagulación con láser argón en rejilla macular es la única terapia que ha demostrado reducir parcialmente la pérdida de AV en un estudio randomizado controlado. Sin embargo, la mejoría era moderada, con un incremento medio de 1,3 líneas de AV a los 3 años de seguimiento, presentando como principal efecto secundario la aparición de escotomas paracentrales (1). La mejoría era mayor cuanto más precozmente se administrara el tratamiento, mejorando 2 o más líneas de visión el 70% de los pacientes que recibían el láser en los primeros 12 meses y solo el 32% de los pacientes tratados tras el primer año de evolución.
La triamcinolona intravítrea (TA) es una opción terapéutica útil, con el inconveniente de que su efecto es temporal y requiere múltiples inyecciones (4-6) y además presenta complicaciones como la hipertensión ocular mantenida (7,8) de difícil manejo (9), el aumento del riesgo de endoftalmitis y el efecto cataratogénico (10). Su seguridad y eficacia está siendo investigada actualmente en el estudio multicéntrico SCORE (Standard Care Versus Corticosteroid for Retinal Vein Occlusion Study) que presentará resultados a finales del años 2009.
El bevacizumab (Avastin; Genentech Inc., San Francisco, California) es un anticuerpo IgG1 monoclonal recombinante humanizado que inhibe el factor de crecimiento endotelial vascular (VEGF) (11). Se ha demostrado que el VEGF está implicado en la aparición de EM y en la neovascularización en distintas retinopatías. De hecho los pacientes con oclusión venosa retiniana presentan un aumento de los niveles de VEGF intravítreo (12). Esta citoquina producida por la retina hipóxica causa un aumento de permeabilidad vascular retiniana lo cual está directamente relacionado con la aparición del EM. Pero además, el VEGF induce la hipertrofia de las células endoteliales retinianas, reduciendo la luz capilar, aumentando la isquemia y con ello la producción de VEGF. Los antiangiogénicos pueden romper este círculo vicioso y favorecer la resolución de edema macular en estas enfermedades.
Desde el 2005 se han publicado varios estudios que avalan buenos resultados en cuanto a eficacia y seguridad a corto plazo con bevacizumab intravítreo en pacientes con EM secundario a ORVR (13-15), pero en general en estos estudios los antiangiogénicos se administraron como terapia de rescate y con frecuencia sumado a otros tratamientos.
El objetivo de este estudio es valorar la utilidad de bevacizumab intravítreo inyectado en las ORVR como primera opción terapéutica.
Material y métodos
Planteamos un estudio en el que se evalúa la eficacia y seguridad del tratamiento del EM secundario a ORVR con 1,25 mg de bevacizumab intravítreo administrado como tratamiento inicial.
Se incluyeron pacientes con EM secundario a ORVR superior a 300 micras medido por OCT (Stratus OCT Carl Zeiss Meditec Inc.,Dublín, CA, USA) y AV igual o inferior a 20/40. Se excluyeron aquellos pacientes que habían recibido otros tratamientos previos o presentaban otras enfermedades oculares.
El objetivo principal era determinar si existía mejoría de AV tras el tratamiento con bevacizumab intravítreo administrado como tratamiento de primera elección en ojos con edema macular secundario a ORVR. Los objetivos secundarios eran determinar los cambios anatómicos medidos con OCT a lo largo del seguimiento y las complicaciones locales o generales asociadas.
El bevacizumab se preparó bajo condiciones de esterilidad en la farmacia hospitalaria a concentración de 1,25 mg/0,05 ml y se administró por vía intravítrea.
En todos los casos se realizó una profilaxis antibiótica tópica (oftacilox ® 1 gota cada 6 horas) los tres días previos y posteriores a la inyección intravítrea; ésta se llevaba a cabo en quirófano bajo condiciones de esterilidad y según la técnica estándar.
El seguimiento se realizó al día, a la semana y al mes de la primera inyección. La decisión de retratar después de la primera inyección se basó en la persistencia de líquido intra o subretiniano medido por OCT, con una frecuencia máxima de reinyección mensual. El seguimiento de los pacientes sin indicación de reinyección se realizó de forma mensual.
Se recogieron datos demográficos como sexo y edad, datos clínicos de AV, grosor macular medido por OCT y presión intraocular (PIO) en cada revisión y se detallaron las complicaciones.
El análisis estadístico se realizó con el paquete SPSS 13.0 utilizando en el análisis descriptivo media, mediana y rango para las variables cuantitativas y el porcentaje para las cualitativas. Se emplearon pruebas no paramétricas para comparar los cambios en la AV y el grosor macular.
Resultados
Se estudiaron 28 pacientes, 13 mujeres y 15 varones que recibieron tratamiento con bevacizumab intravítreo por EM secundario a ORVR. La edad media fue de 62 años, con un rango entre 50 y 72 años.
El tiempo medio de evolución desde el inicio del cuadro hasta la administración del bevacizumab intravítreo fue de 4 meses con un rango de 5 días a 2 años; en 18 de los casos la administración fue en los tres primeros meses de evolución del cuadro oclusivo.
Todos lo pacientes fueron seguidos durante 4 meses y la media de inyecciones por paciente durante este periodo fue de 3 (1-4). En 5 de los 28 casos (27%) sólo fue necesaria una inyección para obtener una resolución permanente del EM.
Se obtuvo una mejoría de AV estadísticamente significativa en todas las revisiones; en la figura 1 se muestra la evolución de la AV a lo largo del seguimiento. Los cambios de agudeza visual con respecto a la basal fueron significativos en cada uno de los cuatro meses evaluados. También se observa una disminución significativa del grosor macular medido por OCT a lo largo del seguimiento (fig. 2).
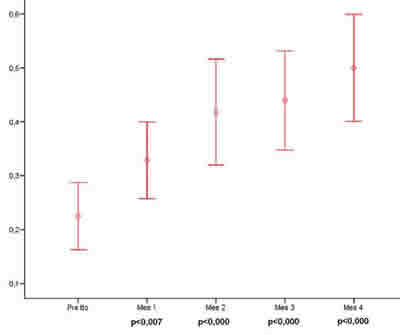
Fig. 1. Cambio de la AV durante el seguimiento.
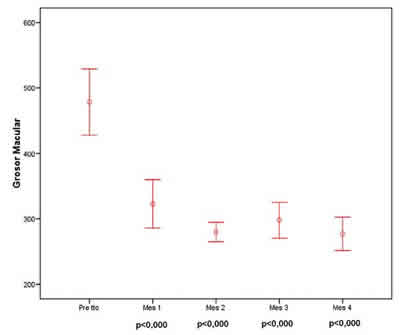
Fig. 2. Cambios del grosor macular medido por OCT a lo largo del seguimiento.
Dos pacientes en la primera revisión mensual (7%) y uno en la segunda (3,5%), presentaron una pérdida de visión superior a dos líneas; sin embargo, a partir del tercer mes no se detectó pérdida de agudeza visual en ninguno de los ojos tratados. A lo largo del seguimiento, los ojos con estabilización de agudeza visual reducen su número progresivamente, mientras que los que mejorar su agudeza visual en 2 o más líneas aumentan progresivamente. El incremento medio de AV a los 4 meses fue de 3 líneas.
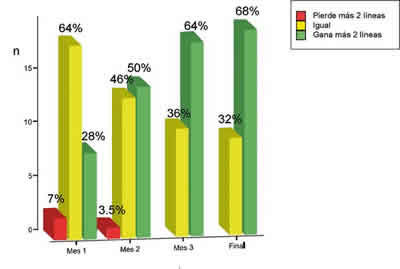
Fig. 3. Evolución de la mejoría de AV.
Se realizaron análisis por subgrupos. Se encontró una correlación entre la AV inicial y AV final (p= 0,0005). También se estableció correlación entre el tiempo de evolución del cuadro oclusivo previo al tratamiento y la agudeza visual final (p=0,047). De modo que los pacientes con mejor AV inicial y los que eran tratados en los 3 primeros meses de evolución, presentaban mejor AV final. Sin embargo no se demostró correlación entre el grosor macular inicial medido por OCT y la AV final (p= 0,141), ni entre el grosor macular y la AV en ningún momento del seguimiento (p=0,94 mes 1; p=0,72 mes 2; p= 0,527 mes 3; p= 0,226 mes 4).
No se encontraron complicaciones locales ni sistémicas secundarias al tratamiento durante los 4 meses de seguimiento
Discusión
La aparición de fármacos como los antiangiogénicos abre una nueva línea de tratamiento en enfermedades que presentaban un tratamiento tradicional poco satisfactorio, como el EM secundario a las oclusiones venosas de la retina. A diferencia de publicaciones previas, en las que el tratamiento con antiangiogénicos se plantea como un tratamiento de rescate, en nuestra serie la inyección intravítrea se realizó como tratamiento de primera elección. Nuestros resultados ponen de nuevo en evidencia los efectos beneficiosos del tratamiento con anti-VEGF en el edema macular secundario a oclusiones de rama venosa, incluso como terapia aislada y de primera elección.
Una vez probada la utilidad del bevacizumab en el tratamiento del EM secundario a ORVR (13-18) persisten una serie de cuestiones sin resolver como son: cuando iniciar el tratamiento, cual debe ser la pauta de seguimiento y el número de reinyecciones.
En nuestro estudio como en otras series (16,19) se obtiene una mejoría de AV en más del 60% de los pacientes y una disminución significativa del grosor macular medido por OCT, durante un seguimiento de 4 meses.
Al igual que Schaal y colaboradores (18) encontramos mejores resultados en los casos de ORVR tratados precozmente (menos de 3 meses de evolución). Estos hallazgos podrían ser debidos a la propia evolución natural de la enfermedad, que tiende en ocasiones a la mejoría espontánea en los primeros meses tras la oclusión venosa, o podrían deberse realmente a un efecto beneficioso del tratamiento cuando éste se inicia precozmente.
Nuestros resultados también sugieren que la agudeza visual final es tanto mayor cuanto mejor sea la agudeza visual inicial.
Al igual que en otras enfermedades vasculares retinianas, no encontramos correlación entre la agudeza visual y el grosor macular medido por OCT. Probablemente porque se producen cambios fisiológicos en la mácula que hacen que aunque mejore la anatomía macular no mejore en la misma medida la AV
Aunque en nuestra serie el porcentaje de casos que se resuelve con una única inyección es importante (28%), lo habitual es que el edema macular recidive entre las 4 y las 6 semanas tras la inyección. Son, por tanto, necesarias múltiples inyecciones para evitar que el edema macular empeoré y que se mantenga la mejoría visual conseguida. El número medio de inyecciones de bevacizumab necesarias en nuestra serie durante los 4 meses de seguimiento fue de 3, lo cual es ligeramente más elevado que en la medio de los estudios previos (16,19-21). La causa probablemente se deba a que nuestro seguimiento fue más estrecho y a que indicamos retratamiento en cuanto se evidenciaba la presencia de líquido intra o subretiniano.
Aunque está descrita la posibilidad de que exista un efecto rebote tras la inyección (22), debido a un aumento de la secreción de VEGF tras el tratamiento crónico, en nuestra serie no lo hemos observado. Tampoco hemos encontrado ninguna de las complicaciones locales descritas con la inyección intravítrea de bevacizumab como son endoftalmitis, aumento de la presión intraocular, desprendimiento de retina, roturas retinianas o desgarros del epitelio pigmentario de la retina (19-21), o complicaciones sistémicas.
Los datos disponibles sugieren que el EM secundario a ORVR, aunque en ocasiones puede resolverse con una única inyección de bavacizumab, generalmente requiere inyecciones repetidas para mantener y estabilizar la mejoría de AV obtenida. Las inyecciones intravítreas repetidas de bevacizumab, no parecen relacionarse con importantes complicaciones locales o sistémicas. Nuestro criterio de retratamiento fue exclusivamente anatómico porque en nuestra opinión los cambios anatómicos preceden a los cambios funcionales. La eficacia es mayor cuanto antes se inicie el tratamiento tras el episodio oclusivo, presentando mejores resultados aquellos pacientes con mejor AV inicial.
Bibliografía
- The Branch Vein Occlusion Study Group. Argon laser photocoagulation for macular edema in branch vein occlusion. Am J Ophthalmol 1984; 98: 271-282.
- The Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for prevention of neovascularization and vitreous hemorrhage in branch vein occlusion: a randomized clinical trial. Arch Ophthalmol 1986; 104: 34-41.
- Finkelstein D et al. Ischemic macular edema. Recognition and favorable natural history in branch vein occlusion Arch Ophthalmol 1992; 110: 1427-434.
- Chen SD , Sundaram V, Lochhead J, Patel CK. Intravitreal triamcinolone for the treatment of ischemic macular edema associated with branch retinal vein occlusion. Am J Ophthalmol 2006; 141: 876-883.
- Cekic O, Chang S, Tseng JJ, et al. Intravitreal triamcinolone injection for treatment of macular edema secondary to branch retinal vein occlusion. Retina 2005; 25: 851-855.
- Jonas JB, Akkoyun I, Kamppeter B, et al. Branch retinal vein occlusion treated by intravitreal triamcinolone acetonide. Eye 2005; 19: 65-71.
- Jonas J, Heatley G, Spaide R, Varma R. Intravitreal triamcinolone acetonide and secondary ocular hypertension. J Glaucoma 2005; 14: 168-171.
- Smithen LM, Ober MD, Maranan L, Spaide RF. Intravitreal triamcinolonen acetonide and intraocular pressure. Am J Ophthalmol 2004; 138: 740-743.
- Kaushik S, Gupta V, Gupta A, et al. Intractable glaucoma following intravitreal triamcinolone in central retinal vein occlusion. Am J Ophthalmol 2004; 137: 758-760.
- Cekic O, Chang S, Tseng JJ, et al. Cataract progression after intravitreal triamcinolone injection. Am J Ophthalmol 2005; 139: 993-998.
- Fung AE, Rosenfeld PJ, Reichel E. The International Intravitreal Bevacizumab Safety Survey: using the internet to assess drug safety worldwide. Br J Ophthalmol 2006; 90: 1344-1349.
- Aiello LP, Avery RL, Arrigg PG, et al. Vascular endothelial growth factor in ocular fluid of patients with diabetic retinopathy and other retinal disorders. N Engl J Med 1994; 331: 1480-1487.
- Rosenfeld PJ, Fung AE, Puliafito CA. Optical coherence tomography findings after an intravitreal injection of bevacizumab (avastin) for macular edema from central retinal vein occlusion. Ophthalmic Surg Lasers Imaging 2005; 36: 336-339.
- Iturralde D, Spaide RF, Meyerle CB, et al. Intravitreal bevacizumab (Avastin) treatment of macular edema in central retinal vein occlusion: a short-term study. Retina 2006; 26: 279-284.
- Rabena MD, Pieramici DJ, Castellarin AA, et al. Intravitreal bevacizumab (Avastin) in the treatment of macular edema secondary to branch retinal vein occlusion. Retina 2007; 27: 419-425.
- Stahl A, Agostini H, Hansen LL, Feltgen N. Bevacizumab in retinal vein occlusion-results of a prospective case series. Graefes Arch Clin Ex Ophthalmol 2007; 245: 1429-1436.
- Pai SA, Shetty R, Vijayan PB, et al. Clinical, anatomic, and electrophysiologic evaluation following intravitreal bevacizumab for macular edema in retinal vein occlusion. Am J Ophthalmol 2007; 143: 601-606.
- Schaal KB, Ho¨h AE, Scheuerle A, et al. Bevacizumab for the treatment of macular edema secondary to retinal vein occlusion. Ophthalmologe 2007; 104: 285-289.
- Kreutzer TC, Alge CS, Wolf AH, kookd, Burger J, Strauss R, Kunze C, Haritoglou C, Kampik A y Priglinger S. Intravitreal bevacizumab for the treatment of macular oedema secondary to branch retinal vein occlusion. Br J Ophthalmol 2008; 92; 351-355.
- Jaissle GB, Leitritz M, Gelisken F, Ziemssen F, Bartz-Schmidt KU, Szurman P. One-year results after intravitreal bevacizumab therapy for macular edema secondary to branch retinal vein occlusion. Graefes Arch Clin Ophthalmol 2009; 247: 27-33.
- Kriechbaum K, Michels S, Prager F, Georgopoulos M, Funk M, Geitzenauer W, Schmidt-Erfurth U. Intravitreal avastin for macular oedema secondary to retinal vein occlusion: prospective study. Br J Ophthalmol 2008; 92: 518-522.
- Matsumoto Y, Freund B, Peiretti E, Cooney MJ, Ferrara D, Yannuzzi L, et al. Rebound macular edema following bevacizumab (avastin) therapy for retinal venous occlusive disease. Retina 2007; 27: 426-31.