Inyección de bevacizumab subconjuntival en neovascularización corneal
Dres. Boto-de-los-Bueis A1, Pastora Salvador N2, del Hierro Zarzuelo A2, Llorente González S2, Zarallo Gallardo J2, San José Valiente B3, Madero Jarabo R3
1 Doctora en Medicina y Cirugía. Servicio de Oftalmología del Hospital Universitario La Paz. Madrid.
2 Licenciada en Medicina y Cirugía. Servicio de Oftalmología del Hospital Universitario La Paz. Madrid.
3 Licenciada en Medicina y Cirugía. Servicio de Bioestadística del Hospital Universitario La Paz. Madrid.
Resumen
Propósito: Evaluar los efectos clínicos de Bevacizumab (BZ) en pacientes con NVC (neovascularización corneal) activa.
Método: Estudio prospectivo realizado entre julio de 2007 y mayo de 2008 sobre 11 pacientes (13 ojos) con NVC que reciben aleatoriamente una inyección mensual subconjuntival de 1,25 mg de BZ (0,05 ml) por cuadrante afectado (grupo BZ), o de suero fisiológico (grupo control) hasta completar 3 dosis. Se analizan la evolución de la AV (agudeza visual) y de la NVC, cuantificando digitalmente la proporción de NVC y opacidad corneal, y manualmente el número de troncos vasculares a nivel limbar, antes y al mes de cada inyección. Otras variables analizadas fueron AV, estado del epitelio corneal y PIO.
Resultados: Nueve pacientes (11 ojos) completaron el estudio. La edad media fue de 64,6 años (25-87 años). Seis ojos en el grupo BZ y 5 ojos en el grupo control. La queratitis herpética fue la patología más frecuente; 2 casos en grupo BZ y 3 casos en grupo control. En ambos grupos la presencia de queratitis herpética se acompañó de peor evolución: En pacientes sin queratitis herpética %NVC disminuyó del 20,39 al 15,87, mientras en pacientes con queratitis herpética el %NVC aumentó del 14,223 al 23,844. La agudeza visual (AV) no mostró diferencias entre los grupos BZ/control. Al finalizar el tratamiento la proporción de NVC aumentó en el grupo BZ del 13,045% pre-tratamiento al 14,276% pos-tratamiento, mientras que en los controles empeoró del 21,04% pre-tratamiento al 25,76% pos-tratamiento, sin diferencia significativa. De los 6 pacientes tratados con BZ en 5 disminuyó la NVC, aumentando aisladamente en una paciente con NVC por herpes y 2.º injerto fallido. La mayor reducción de la NVC con BZ se produjo en una paciente con queratoconjuntivitis límbica superior (QCLS), con vasos de pequeño calibre, que mejoró 3 líneas de Snellen de visión. En el grupo control la NVC empeoró en 4 de 5 casos.
Conclusiones: El bevacizumab subconjuntival es bien tolerado y se asocia con una estabilización de la NVC, principalmente en neovasos finos de córneas con inflamación leve. En los casos de angiogénesis más activa, como en algunas queratitis intersticiales herpéticas, el bevacizumab no es capaz de provocar la regresión total de los neovasos.
Introducción
La córnea es una estructura avascular, sin embargo ciertas condiciones como hipoxia o inflamación inducen la sobre-expresión de factores angiogénicos favoreciendo el desarrollo de neovasos que brotan de los capilares y vénulas del plexo limbar. Dentro de la cascada angiogénica la proteína VEGF (factor de crecimiento endotelial vascular) es un elemento necesario en la NVC (neovascularización corneal). A pesar de la difusión de varios fármacos dirigidos contra este factor en neovascularización coroidea (Pegaptanib-Macugen, Ranibizumab-Lucentis), en NVC la mayoría de estudios publicados hacen referencia al anti-VEGF Bevacizumab; un anticuerpo monoclonal recombinante humanizado. El Bevacizumab (BZ) actúa a varios niveles de la angiogénesis; actividades proteolíticas, proliferación de células endoteliales, migración, formación tubular capilar, y es capaz de inhibir tanto hemangiogénesis como linfangiogénesis corneal en aplicación tópica ocular (1). La oclusión del neovaso permite restablecer el privilegio inmune de la córnea, y mejorar la función visual al disminuir las consecuencias clínicas de la NVC, edema y opacidad.
Presentamos un estudio prospectivo evaluando la eficacia de BZ subconjuntival en pacientes con NVC de diversa etiología, y comparamos los resultados con un grupo de pacientes con NVC en los que se inyecta placebo. Hasta el momento, es el primer estudio realizado en humanos que dispone de grupo control.
Método
Se realizó un estudio aleatorizado prospectivo sobre 11 pacientes adultos (13 ojos) con NVC superficial o profunda de diversa etiología, persistente a pesar de tratamiento corticoideo y de más de 3 semanas de evolución. Los pacientes fueron tratados en consultas externas de forma ambulatoria. En primer lugar se informaba a los pacientes de las características del estudio, y se aleatorizaba (grupo BZ/grupo placebo) cada ojo enfermo a los que consentían en su participación. El procedimiento se realizó bajo anestesia tópica-tetracaína 0,1% y oxibuprocaína 0,4% clorhidrato (Colircusí Anestésico Doble, Cusí), y medidas de asepsia (povidona yodada al 5%), con el paciente sentado en la lámpara de hendidura. Cada ojo del grupo BZ recibió 1 inyección mensual subconjuntival próxima a limbo esclero corneal de 0,05 mL (1,25 mg) de BZ estéril no diluído (100 mg/4 mL intravenoso; Avastin ® , Roche, Suiza) por cuadrante afectado, hasta completar 3 dosis, considerando «pos tratamiento» los resultados al mes de la última inyección. Los pacientes recibían colirio ofloxacino 0,3% (Exocin, Allergan)/8 h durante 5 días tras cada inyección. El tratamiento de la queratopatía de base no fue modificado durante el seguimiento. En el grupo control se realizó el mismo procedimiento pero inyectando suero fisiológico.
El seguimiento incluyó AV csc (con su corrección) y AV máxima (csc y estenopeico), biomicroscopía óptica, fotografía digital y PIO en los días 4, 15 y 30 de cada inyección. Las fotografías digitales de la córnea fueron analizadas para cuantificar el área de NVC y de opacidad, realizando dos mediciones de cada variable de las cuales se calculaba la media. La cantidad de NVC/opacidad fue medida en las fotografías como el porcentaje del área corneal total (número de píxeles del área afectada respecto al número de píxeles del área corneal total, ambas áreas dibujadas a mano alzada): Para el cálculo de áreas se utilizó el procesador y analizador de imagen ImageJ 1.38v (Wayne Rasband at the Research Services Branch, National Institute of Mental Health, Bethesda, MD, http://rsb.info.nih.gov/ij). La densidad de la NVC fue cuantificada en cada fotografía como número de troncos vasculares de tamaño significativo que cruzaban el limbo corneal. Las variables con análisis impreciso por la calidad de la imagen eran desestimadas.
Se utilizó el test de Wilcoxon para el análisis de las variables randomizadas, considerando estadísticamente significativas probabilidades menores al 5% (SPSS, Chicago, IL).
Resultados
Once pacientes fueron incluidos en el estudio (13 ojos), dos de los cuales fueron excluidos del análisis por eventos intercurrentes durante el protocolo; un varón por pancreatitis aguda y una mujer por una endoftalmitis por neumococo. De los 9 pacientes estudiados (11 ojos/casos) el número de inyecciones por paciente fue de 3, excepto un caso (caso 7) que interrumpió el protocolo con 2 inyecciones por queratoplastia penetrante. La edad media fue de 64,6 años (25-87 años), 5 varones y 4 mujeres.
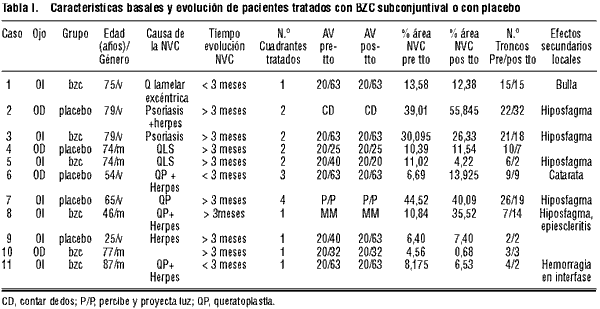
La tabla I resume las características de los pacientes.
El cambio de AV en número de líneas de Snellen al mes de la última inyección no mostró diferencia significativa entre grupo BZ y grupo control: En los casos 5 y 10 (grupo BZ) se observó un efecto beneficioso en picos, con mejoría precoz de la AV próxima al momento de inyección, y caída antes del mes (gráfica 1) y únicamente en el caso 5 hubo una mejoría en la AV mejor corregida de 3 líneas al finalizar el protocolo.
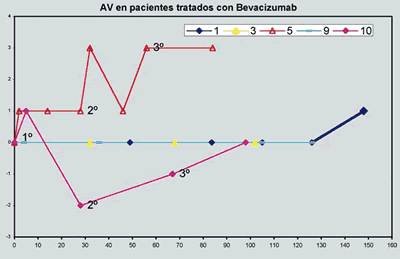
Gráfica 1. Evolución de la máxima AV en pacientes tratados con BZ. La AV está representada como número de líneas de Snellen ganadas (+) o perdidas (-) (eje y) respecto al momento basal o día 0 (eje x).
No se recogieron complicaciones sistémicas ni cambios significativos en la PIO. Cinco ojos presentaron hiposfagma en el momento de la inyección (2 casos/2 controles), un caso hemorragia en la interfase donante/receptor (caso 11, grupo BZ), y en un paciente la inyección produjo una bulla subepitelial en el injerto lamelar excéntrico que se resolvió en el día 4 postinyección (caso 1, grupo BZ). Una paciente presentó dolor y epiescleritis la misma tarde de la 2.ª inyección (caso 8, grupo BZ). Dos ojos tratados con BZ presentaron queratitis punteada superficial.
Los pacientes con NVC por queratitits intersticial herpética evolucionaron peor en el grupo BZ y en el grupo control; En pacientes sin queratitis herpética %NVC disminuyó del 20,39 al 15,87%, mientras en pacientes con queratitis herpética el %NVC aumentó del 14,223 al 23,844% (gráfica 2).
Al finalizar el tratamiento la proporción de NVC aumentó en el grupo BZ del 13,045% pre-tratamiento al 14,276% pos-tratamiento, mientras que en los controles empeoró del 21,04% pre-tratamiento al 25,76% pos-tratamiento, sin diferencia significativa. De los 6 pacientes tratados con BZ en 5 disminuyó la NVC (gráfica 2), y en 3 de los mismos también disminuyó el número de troncos vasculares (gráfica 3). El caso 8 sufrió un empeoramiento de la NVC a pesar del tratamiento (fig. 1). Esta paciente presentaba una queratitis intersticial herpética corticodependiente en un 2.º injerto corneal fallido con AV de MM basal; finalizado el protocolo la NVC se estabilizó con el aumento de corticóide tópico.
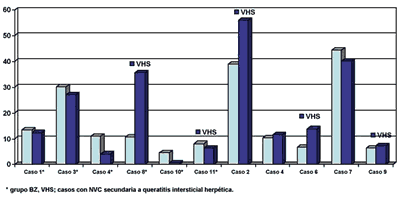
Gráfica 2. Evolución de la NVC en el grupo estudio BZ y grupo control.
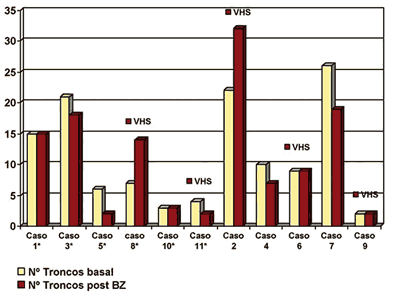
Gráfica 3. Evolución del n.º de troncos vasculares en limbo en pacientes tratados con BZ* y en grupo control.
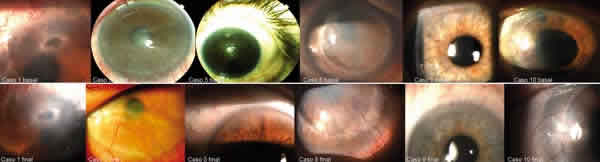
Fig. 1.
En la paciente con QCLS el OI fue tratado con BZ y el OD con placebo. Ambos ojos presentaban vasos superiores de pequeño calibre, a diferencia de los otros ojos del grupo BZ con vasos de mayor calibre: En OI tratado con BZ (caso 5), se observa una disminución del %NVC del 11,02% basal al 4,22% al mes de la 3.ª inyección de BZ, pero la NVC aumenta hasta el 12,615% al 6.º mes de evolución. Este aumento del %NVC es más significativo en el OD control (caso 4) (aumenta del 10,39% al 16,035% al 6.º mes de evolución) (gráfica 4). La AV en OI mejoró 3 líneas de visión permaneciendo estable en el OD (gráfica 5). El % de opacidad corneal fue valorado en 6 ojos al mes de la primera inyección, en el grupo placebo aumentó la opacidad en 3 de 4; en el grupo BZ 1 aumentó y 1 disminuyó.
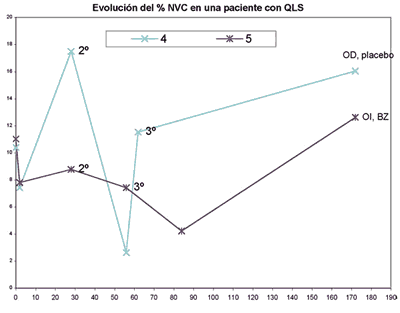
Gráfica 4. Comparación del curso clínico en una paciente con QLS tratada con placebo (OD) y con BZ (OI). En el eje X se muestran los días de evolución, siendo el "día 0", la situación basal de la paciente que corresponde a la primera inyección de BZ o placebo. En el eje Y viene representada la proporción de NVC respecto al área corneal total.
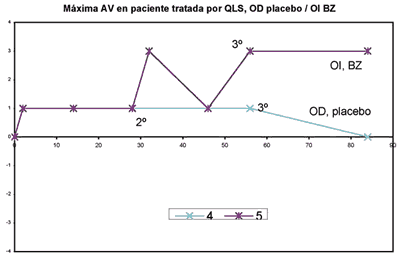
Gráfica 5. Comparación de AV en paciente con QLS, OD placebo/OI BZ. En el eje "Y" se muestra al AV en líneas ganadas (0 a +4) o pérdidas (-4 a 0) y en el eje "X" los días de evolución, siendo el día "0" la situación basal de la paciente y la fecha de la primera inyección.
Discusión
El efecto clínico del Bevacizumab en NVC ha sido demostrado en estudios experimentales (2-7) y en diversas patologías en humanos (8-12). Hasta el momento parece evidente que es un fármaco capaz de provocar la regresión, inhibición y estabilización de neovasos jóvenes, y la reducción en la perfusión vascular de vasos más antiguos, sin embargo ejerce un efecto parcial y limitado en el tiempo, y se desconocen cuáles son los factores individuales predictores de buena respuesta. En el momento actual, las series publicadas ofrecen resultados diversos sino contradictorios en cuanto a eficacia y seguridad.
Analizando la eficacia por patología vemos, por ejemplo, que en pterigyum tratados durante 3 meses con BZ subconjuntival (8) no se consigue regresión vascular, mientras en colirio al 1,25% 2 veces al día (9) se obtiene una regresión parcial que estabiliza su crecimiento. En injertos cornales vascularizados, Bahar analiza como nosotros el %NVC en 3 casos y encuentra una tímida disminución del 14,40% al 12,13%. En el caso de mayor regresión (15,98 al 9,03%) mejora también la AV (10).
La respuesta a BZ es mejor y más homogénea en patología inflamatoria no herpética que podríamos considerar poco agresiva o de «bajo grado de inflamación», pero los casos publicados son escasos (1 queratitis intersticial (10), 1 queratitis filamentosa (11) y nuestro caso de QCLS), y en estos pacientes con inflamación crónica cabría preguntarse ¿hasta cuándo tratar?
En nuestra serie el virus Herpes parece ser el factor más influyente en la progresión de la NVC tanto en tratados como en el grupo control. Kim muestra un caso de queratits herpética con regresión parcial y mejoría de 1 línea de AV tras 2 meses de tratamiento tópico con BZ, que se mantiene 5 meses finalizado el tratamiento (10). En otra paciente tratada precozmente la regresión de la NVC fue total y mantenida con una única inyección de 1,25 mg y sin utilizar corticóides tópicos (12). Otros 2 casos publicados muestran regresión vascular únicamente a partir de la tercera inyección de BZ (10). Nuestro estudio evalúa casos de NVC activa no controlada con corticóides tópicos. El tratamiento de los pacientes no fue modificado hasta finalizar el protocolo, por lo cual se evalúa el efecto antiangiogénico exclusivamente del BZ. En el caso 8 de nuestra serie 3 inyecciones de BZ no controlaron la queratitis intersticial herpética progresando la NVC del 10,84 al 35,52%, situación que fue controlada posteriormente aumentando el corticoide tópico. El control de la inflamación es crucial en la inhibición y regresión de neovasos; en queratitis herpéticas con NVC reciente y con poca inflamación quizás el BZ tópico o inyectado sea una alternativa al corticoide. En casos más severos el tratamiento aislado de la angiogénesis con BZ no es suficiente, pero podría disminuir el requerimiento de corticoides tópicos disminuyendo así sus efectos secundarios.
Nuestro estudio muestra una disminución y estabilización en la NVC de los pacientes tratados con BZ en 5 de 6 pacientes, respecto al grupo control. El caso más demostrativo es la paciente con QCLS en AO, en la que se observa una regresión en la NVC y una mejoría en la AV del ojo tratado respecto al control. Este efecto no se mantiene sin embargo, al interrumpir la inyección del fármaco. Curiosamente en el ojo control también observamos una disminución del %NVC tras la 1.ª y 2.ª inyección de suero fisiológico: Este efecto podría ser explicado por la absorción del fármaco desde el OI a nivel sistémico, o bien por un efecto compresivo sobre los vasos al inyectar un volúmen de suero fisiológico en su proximidad.
El metabolismo del BZ no se conoce con nitidez, pero parece que se ubica en el retículo endoplásmico, estimándose en 12-20 días su vida-media de eliminación (13); este período es sobrepasado por el intervalo de reinyección mensual de nuestro estudio, limitando quizás la eficacia del fármaco. Por otro lado, los pacientes tratados con inyecciones subconjuntivales de BZ en nuestro estudio y en la mayoría de los publicados (14,15), son casos de vasos antiguos en córneas con patología crónica cuya inflamación mantenida perpetúa el estímulo angiogénico. La estabilización del vaso neoformado, recubriéndose con pericitos, es muy precoz y disminuye su dependencia a VEGF (16). Por tanto, y como demuestran tanto estudio experimentales, como casos clínicos aislados (12), es lógico pensar que la eficacia será mayor cuanto más acerquemos el tratamiento al insulto inductor de la NVC. En vasos antiguos podría ser más eficaz la combinación de BZ con terapias físicas (argon, terapia fotodinámica), o asociado a otros fármacos antiangiogénicos (triamcinolona) (17).
La seguridad del fármaco empleado de forma tópica fue reconocida experimentalmente tanto para células del epitelio como del endotelio corneal (2). Los casos de tratamiento tópico en humanos muestran resultados dispares aún tratando patología similar. Algunos observan mejoría del estado epitelial con BZ tópico al 2,5%/6 h durante 3 meses sin conservantes (15) mientras otros no aprecian cambios utilizando el colirio al 1% en cloruro de benzalconio (18). El estudio detallado de Kim describe sin embargo la aparición de úlceras epiteliales (5 de 7 casos de NVC de diversa etiología) con el uso prolongado (> 4 semanas) de BZ al 1,25%/12 h sin conservantes; estas lesiones revierten al retirar el fármaco pero algunas se acompañaron de adelgazamiento estromal (9). En nuestra serie la inyección subconjuntival, aparte del hiposfagma provocado por la inyección, ocasionó una bulla subepitelial en un injerto lamelar, y una epiescleritis anterior en la zona de inyección. Estos efectos parecen más relacionados con la técnica de inyección que con el propio fármaco.
El BZ ejerce un efecto vascular oclusor parcial y agotable, pero capaz de estabilizar la AV y la NVC en nuestros pacientes con patología corneal crónica, es bien tolerado y está exento de las complicaciones relacionadas con otros fármacos antiangiogénicos como los corticoides oculares. Derivado de su efecto oclusor vascular y linfático se desprende la posibilidad de restaurar el privilegio inmune, y de mejorar la transparencia y AV en enfermedades diversas que cursan con NVC.
Bibliografía
- Bock F, Onderka J, Dietrich T, Bachmann B, Kruse FE, Paschke M, Zahn G, Cursiefen C. Bevacizumab as a potent inhibitor of inflammatory corneal angiogenesis and lymphangiogenesis. Invest Ophthalmol Vis Sci 2007; 48: 2545-2552.
- Yoeruek E, Ziemssen F, Henke-Fahle S, Tatar O, Tura A, Grisanti S, Bartz-Schmidt KU, Szurman P. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmol Scand 2007 Nov 8.
- Manzano RP, Peyman GA, Khan P, Carvounis PE, Kivilcim M, Ren M, Lake JC, Chévez-Barrios P. Inhibition of experimental corneal neovascularisation by bevacizumab (Avastin). Br J Ophthalmol 2007; 91: 804-807.
- Hurmeric V, Mumcuoglu T, Erdurman C, Kurt B, Dagli O, Durukan AH. Effect of subconjunctival bevacizumab (avastin) on experimental corneal neovascularization in Guinea pigs. Cornea 2008; 27: 357-362.
- Kim TI, Kim SW, Kim S, Kim T, Kim EK. Inhibition of experimental corneal neovascularization by using subconjunctival injection of bevacizumab (Avastin). Cornea 2008; 27: 349-352.
- Papathanassiou M, Theodossiadis PG, Liarakos VS, Rouvas A, Giamarellos-Bourboulis EJ, Vergados IA. Inhibition of corneal neovascularization by subconjunctival bevacizumab in an animal model. Am J Ophthalmol 2008; 145: 424-431.
- Hosseini H, Nejabat M, Mehryar M, Yazdchi T, Sedaghat A, Noori F. Bevacizumab inhibits corneal neovascularization in an alkali burn induced model of corneal angiogenesis. Clin Experiment Ophthalmol 2007; 35: 745-748.
- Bahar I, Kaiserman I, McAllum P, Rootman D, Slomovic A.Subconjunctival bevacizumab injection for corneal neovascularization in recurrent pterygium. Curr Eye Res 2008; 33: 23-28.
- Kim SW, Ha BJ, Kim EK, Tchah H, Kim TI. The effect of topical bevacizumab on corneal neovascularization. Ophthalmology 2008; 115: e33-8. Epub 2008 Apr 24.
- Bahar I, Kaiserman I, McAllum P, Rootman D, Slomovic A. Subconjunctival bevacizumab injection for corneal neovascularization. Cornea 2008; 27:142-147.
- Erdurmus M, Totan Y. Subconjunctival bevacizumab for corneal neovascularization. Graefes Arch Clin Exp Ophthalmol 2007; 245: 1577-1579.
- Carrasco MA. Subconjunctival bevacizumab for corneal neovascularization in herpetic stromal keratitis. Cornea 2008; 27: 743-745.
- Lin YS, Nguyen C, Mendoza JL. Preclinical pharmacokinetics, interspecies scaling, and tissue distribution of a humanized monoclonal antibody against vascular endothelial growth factor. J Pharmacol Exp Ther 1999; 288: 371-378.
- Bock F, König Y, Kruse F, Baier M, Cursiefen C. Bevacizumab (Avastin) eye drops inhibit corneal neovascularization. Graefes Arch Clin Exp Ophthalmol 2008; 246: 281-4.
- Uy HS, Chan PS, Ang RE. Topical bevacizumab and ocular surface neovascularization in patients with stevens-johnson syndrome. Cornea 2008; 27: 70-73.
- Cursiefen C, Hofmann-Rummelt C, Küchle M, Schlötzer-Schrehardt U. Pericyte recruitment in human corneal angiogenesis: an ultrastructural study with clinicopathological correlation. Br J Ophthalmol 2003; 87: 101-106.
- Harooni H, Reddy V, Root T, Ambati B. Bevacizumab for graft rejection. Ophthalmology 2007; 114: 1950.
- DeStafeno JJ, Kim T. Topical bevacizumab therapy for corneal neovascularization. Arch Ophthalmol 2007; 125: 834-836.