Nuevos esquemas para comprender mejor las sequedades oculares
Baudouin C1
1 Centre National d'Ophtalmologie des Quinze-Vingts. Paris.
Original en francés. Traducción por Juan Murube
Los síndromes secos oculares constituyen, con la catarata y la degeneración macular asociada a la edad, la principal patología oftalmológica de la persona de edad. Se considera que entre el 15 y el 25% de la población de más de 65 años se tratan regularmente con substitutivos lacrimales. De ellos, la mayor parte sufren irritación y discomfort crónicos, y el impacto en su calidad de vida, e incluso en su visión, es a menudo muy importante, con un efecto de desgaste psicológico ligado a este dolorimiento casi permanente, que es bastante mal aliviado por los tratamientos actuales (1).
La clasificación etiológica de los síndromes secos, publicada en 1995 (2) y retomada en 2007 (3), propone diferentes tipos etiológicos con una multitud de enfermedades que pueden provocar síndromes oculares secos. Sin embargo, no se ve bien cómo todas estas enfermedades pueden conducir a manifestaciones bastante similares, y deja sin aclarar numerosos interrogantes a los que estas clasificaciones responden mal.
En efecto, ¿cómo comprender que un síndrome seco se desarrolle a continuación de una conjuntivitis viral y persista varios años después aunque se evidencie que ya no existe la virasis? De igual manera ¿cómo entender el porqué ciertos pacientes se quejan fuertemente a continuación de una intervención quirúrgica (catarata o cirugía refractiva) perfectamente ejecutada y tienen signos de sequedad en el ojo que no ha sido tocado? ¿Por qué algunos portadores de lentillas de contacto que han renunciado a usarlas por tener sequedad, continúan sufriéndola? ¿Es la sequedad la que ha hecho que no se puedan soportar las lentillas, o es el porte de las lentillas lo que a lo largo del tiempo ha terminado por modificar la película lacrimal hasta el extremo de que incluso la supresión del factor causal no mejora al paciente? Nosotros aceptamos aquí las clasificaciones y definiciones clásicas, pero también un nuevo esquema fisiológico destinado o intentar responder a estos interrogantes gracias a una visión no etiológica, sino mecanicista.
Principios de las clasificaciones y definiciones actuales
La definición y la clasificación citadas fueron publicadas por Lemp et al. (2) tras una reunión de trabajo formada por expertos internacionales, con la finalidad de clasificar los diferentes tipos de sequedad ocular. La definición fue la siguiente: «El ojo seco es un desorden de la película lacrimal debido a un déficit de lágrima o a una evaporación excesiva, provocando un daño de la superficie ocular de la hendidura palpebral al que se asocian síntomas de discomfort ocular.
Dry eye is a disorder of the tear film due to tear deficiency or excessive evaporation, which causes damage to the interpalpebral ocular surface and is associated with symptoms of ocular discomfort (2).
Esta definición, poniendo su énfasis en los mecanismos generales, daba un carácter demasiado benigno a esta afección, y no tenía en cuenta los nuevos descubrimientos fisio-patológicos, en particular los relativos al papel central de la inflamación surfocular. Una nueva reunión de trabajo se desarrolló entre 2004 y 2006, y publicó sus conclusiones en 2007 (3). Se validó una nueva definición más adaptada a la gravedad real de la enfermedad y de sus mecanismos biológicos: «El ojo seco es una enfermedad multifactorial de la lágrima y de la superficie ocular que incluye síntomas de discomfort, molestias visuales e inestabilidad lacrimal, con riego de dañar la superficie ocular. Se acompaña de un aumento de la osmolaridad de la película lacrimal y de una inflamación de la unidad funcional que constituye la superficie ocular.»
Dry eye is a multifactorial disease of the tears and ocular surface that results in symptoms of discomfort, visual disturbance, and tear film instability, with potential damage to the ocular surface. It is accompanied by increased osmolarity of the tear film and inflammation in the ocular surface functional unit (3).
Los principales elementos que aparecen en esta definición son las nociones de enfermedad, de daño visual y el papel central de la inflamación, que constituirá en lo sucesivo un blanco terapéutico importante. La clasificación etiológica de Lemp, de 1995, fue retomada en 2007. Diferencia globalmente los síndromes secos por hiposecreción, como el síndrome de Gougerot-Sjögren, de los síndromes secos por inestabilidad de la película lacrimal. Esta inestabilidad de la película lacrimal, cualquiera que sea su mecanismo, contribuye a producir una hiperevaporación de la lágrima.
Una tercera clasificación resulta igualmente de un trabajo de expertos, y ha buscado completar la clasificación clásica de 1995, estableciendo aspectos fisiopatológicos y de grados de severidad, más allá del simple aspecto etiológico: es la Triple Clasificación (de Madrid) publicada en 2005 (4).
Las dos grandes categorías dan cuenta de los síndrome secos cualitativos y cuantitativos (fig. 1), ciertamente aún más frecuentes que los primeros. En esta categoría de inestabilidad lacrimal pueden incluirse las alergias crónicas, las blefaritis, las disfunciones meibomianas, la rosácea, los factores ambientales, el porte de lentillas de contacto, o los tratamientos tópicos crónicos (5-8). Se podría añadir, si ello no había estado previsto inicialmente, una categoría de patologías agudas como las conjuntivitis virales, una intervención quirúrgica, la utilización a fuertes dosis de colirios irritantes o substancias tóxicas, los fenómenos alérgicos agudos que entrañan un stress inflamatorio de la superficie ocular y que, todos ellos, pueden seguirse meses o años después de fenómenos secretorios hipolacrimales o de inestabilidad lacrimal crónica, desconectados, al menos en el tiempo, del factor causal identificado.
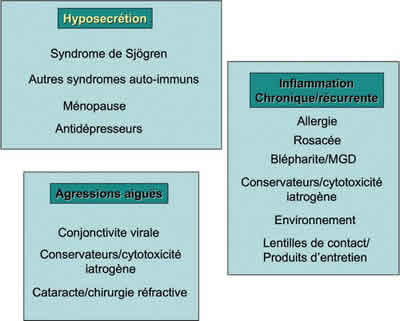
Fig. 1. Diferentes categorías etiológicas de los síndromes secos: clasificación inspirada en la de Lemp et al, 1995 (2).
Esta clasificación tiene el mérito de hacer énfasis en la importancia de la inestabilidad lacrimal y consiguientemente del fenómeno cualitativo, pero no explica el porqué las enfermedades ya desaparecidas pueden ocasionar fenómenos cercanos por no decir comunes. No explica la aparente desconexión entre un factor inicial, eventualmente suprimido desde su identificación y de su tratamiento, y una serie de manifestaciones repetitivas posteriores.
Nueva aproximación fisiopatológica de la afección lacrimal: La inflamación (9)
Hace años que la literatura es abundante en estudios realizados in vitro sobre modelos experimentales o en humanos, interesándose en los mediadores implicados en la sequedad ocular (10-12). Los principales elementos encontrados se agrupan en varias categorías en las que se puede citar la hiperosmolaridad de la película lacrimal (13), la apoptosis de las células surfoculares (14,15), la estimulación nerviosa responsable de una inflamación (16) y, sobre todo, la activación de mediadores inflamatorios a todos los niveles de la superficie ocular (12,17,18):
La figura 2 intenta reunir en un concepto unicista los lazos que pueden existir entre estos diferentes fenómenos, aparentemente dispares. Si se parte de los conceptos iniciales de inestabilidad lacrimal o de hiposecreción, se aprecia que tanto el uno como el otro entrañan una hiperosmolaridad lacrimal y probablemente celular en las zonas no protegidas por una película lacrimal normal. Esta hiperosmolaridad es inicialmente responsable de un sufrimiento celular, que a nivel de la córnea puede favorecer una keratitis, y que en sus formas mínimas produce series de descargas nerviosas que envían al cerebro señales de alerta a causa del sufrimiento tisular inducido.
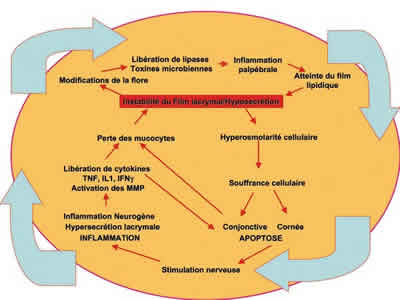
Fig. 2. Bucles fisiopatológicos haciendo interactuar la inestabilidad lacrimal, y los fenómenos inflamatorios, neurogénicos y apoptóticos, que conducen al círculo vicioso.
A nivel conjuntival, un sufrimiento celular es responsable de una apoptosis aumentada ejercida sobre las células conjuntivales y sobre una estructura particularmente frágil de la conjuntiva, los mucocitos, cuya destrucción es el signo citológico más característicos de los síndromes secos (6,11). La estimulación nerviosa inducida por este daño de la superficie ocular va a estimular un arco normal destinado a aumentar la secreción lacrimal y a activar por las terminaciones nerviosas conjuntivales y corneales la secreción de mucus y la estimulación de los sistemas defectivos locales. Pero sobre una superficie ocular patológica y/o unas glándulas lacrimales patológicas, esta estimulación nerviosa puede impulsar un efecto de agotamiento o una sobreestimulación que determine un lagrimeo paradójico En todos los casos acaba produciendo una inflamación local denominada inflamación neurógena (16). Ésta, aunque actualmente aún faltan elementos para comprender todos los mecanismos, ha estado bien identificada en las sequedades oculares y en todas las patología crónicas surfoculares (5,18-20).
La inflamación producida por el ambiente y por la estimulación neuronal se hace progresivamente excesiva e ineficaz, y conduce a la liberación de citokinas pro-inflamatorias, TNFalpha, interleukinas, interferon gamma (12), a la expresión anormal de antígenos de clase II y de citokinas del sistema linfocitario TH1 (9,17), así como a la activación de metaloproteinasas (10,21), que transforman los precursores inactivos de las citokinas inflamatorias en sus formas activadas, determinando una reacción inflamatoria en cadena, ella misma citotóxica para la superficie ocular, especialmente para las células mucíparas. Se completa así el arco, manifestando cómo una inestabilidad lacrimal o una hiposecreción , por el sesgo de esta reacción en cadena, acaba en una destrucción de mucocitos, a su vez responsable de una inestabilidad suplementaria de la película lacrimal.
Un segundo arco, surgido de una inestabilidad lacrimal, puede igualmente intervenir y mostrar la importancia de los párpados y del sistema lípido. En efecto, una película lacrimal inestable o insuficiente puede modificar la flora microbiana a nivel de la conjuntiva y de los párpados, flora que por su parte va a liberar lipasas y toxinas bacterianas producidas por bacterias Gram+ o Gram-, asociándose a una inflamación palpebral y meibomiana, y produciendo modificaciones de la composición lípida que determina a su vez una inestabilidad lacrimal suplementaria (3,22,23).
La figura 2 incluye todos estos elementos y muestra cómo este sistema biológico se comporta como un verdadero círculo vicioso, de forma que cuando el ojo entra en este tipo de engranaje o sistema, no tiene ningún medio espontáneo para salir de él. Esto nos permite comprender por qué este sistema patológico, cuando se inicia, puede perfectamente desconectarse de la causa inicial.
La encrucijada de los esquemas fisio-patológicos
La figura 3 tiene por objeto reunir las dos clasificaciones. Permite asociar las etiologías ya identificadas en la clasificación clásica y la figura 1, presentando las etiologías como las formas de entrada en el engranaje, y no como enfermedades autónomas. Esta comprensión permite mostrar que el daño de la película lacrimal, cuando se autonomiza o independiza, no tiene obligatoriamente necesidad de estar mantenido por su causa inicial. Esta causa puede ser única, o ser la acumulación de fenómenos menores que, sumados los unos a los otros, harán entrar al ojo en el citado círculo vicioso.
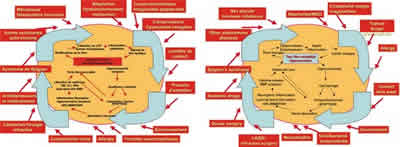
Fig. 3. Reunión de los círculos viciosos y de las etiologías que determinan los modos de entrada en una enfermedad autónoma de la superficie ocular, y no como enfermedades independientes.
Para cortar este círculo vicioso, se puede actuar sobre los aspectos etiológicos cuando ello sea posible, o sobre los mecanismos biológicos subyacentes. Esta es la razón por la que la inflamación se considera no sólo como un mecanismo, sino como un blanco u objetivo terapéutico, por ejemplo mediante el uso de ciclosporina A como tratamiento de la keratitis sicca. Una primera etapa para atacar las raíces de la enfermedad, y no solamente a sus síntomas.
Bibliografía
- Goto E, Yagi Y, Matsumoto Y, Tsubota K. Impaired functional visual acuity of dry eye patients. Am J Ophthalmol 2002; 133: 181-6.
- Lemp MA. Report of the National Eye Institute/Industry Workshop on Clinical Trials in Dry Eye CLAO J 1995; 21: 221-32.
- Lemp MA, Baudouin C, Baum J, et al. The definition and classification of dry eye disease: Report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocular Surface 2007; 5: 75-92.
- Murube J, Németh J, Höh H, et al. The triple classification of dry eye for practical clinical use. Eur J Ophthalmol 2005; 15: 660-7.
- Stern ME, Gao J, Siemasko KF, Beuerman RW, Pflugfelder SC. The role of the lacrimal functional unit in the pathophysiology of dry eye. Exp Eye Res 2004; 78: 409-16.
- Pisella PJ, Brignole F, Debbasch C, et al. Flow cytometric analysis of conjunctival epithelium in ocular rosacea and keratoconjunctivitis sicca. Ophthalmology 2000; 107: 1841-9.
- Sullivan DA. Sex and sex steroid influences on the dry eye syndrome. In, Dry Eye and Ocular Surface Disorders, (2004) eds. SC Pflugfelder, R,W Beuerman and M.E.Stern, pub. Marcel Dekker, New York.
- Baudouin C, Liang H, Bremond-Gignac D, et al. CCR 4 and CCR 5 expression in conjunctival specimens as differential markers of T(H)1/ T(H)2 in ocular surface disorders. J Allergy Clin Immunol 2005; 116: 614-9.
- Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007; 30: 239-46.
- Pflugfelder SC, de Paiva CS, Tong L, Luo L, Stern ME, Li DQ. Stress-activated Protein Kinase Signaling Pathways in Dry Eye and Ocular Surface Disease. Ocul Surf 2005; 3(4 Suppl): S154-7.
- Pisella PJ, Debbasch C, Hamard P, Creuzot-Garcher C, Brignole F, Baudouin C. Conjunctival proinflammatory and proapoptotic effects of latanoprost and preserved and unpreserved timolol: an ex vivo and in vitro study. Invest Ophthalmol Vis Sci 2004; 45: 1360-8.
- Pflugfelder SC, Jones D, Ji Z, Afonso A, Monroy D. Altered cytokine balance in the tear fluid and conjunctiva of patients with Sjogren's syndrome keratoconjunctivitis sicca. Curr Eye Res 1999; 19: 201-11.
- Bron AJ, Tiffany JM, Yokoi N, Gouveia SM. Using osmolarity to diagnose dry eye: a compartmental hypothesis and review of our assumptions. Adv Exp Med Biol 2002; 506: 1087-95.
- Gao J, Schwalb TA, Addeo JV, Ghosn CR, Stern ME. The role of apoptosis in the pathogenesis of canine keratoconjunctivitis sicca: the effect of topical Cyclosporin A therapy. Cornea 1998; 17: 654-63.
- Yeh S, Song XJ, Farley W, Li DQ, Stern ME, Pflugfelder SC. Apoptosis of ocular surface cells in experimentally induced dry eye. Invest Ophthalmol Vis Sci 2003; 44: 124-9.
- Beuerman RW, Stern ME. Neurogenic inflammation: a first line of defense for the ocular surface. Ocul Surf 2005; 3(4 Suppl): S203.
- Brignole F, Pisella PJ, Goldschild M, De Saint Jean M, Goguel A, Baudouin C. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000; 41: 1356-63.
- Zierhut M, Dana MR, Stern ME, Sullivan DA. Immunology of the lacrimal gland and ocular tear film. Trends Immunol 2002; 23: 333-5.
- Baudouin C. The pathology of dry eye. Surv Ophthalmol 2001; 45 Suppl 2: S211-20.
- Stern ME, Pflugfelder SC. Inflammation in dry eye. Ocul Surf 2004; 2: 124-30.
- Corrales RM, Stern ME, De Paiva CS, Welch J, Li DQ, Pflugfelder SC. Desiccating stress stimulates expression of matrix metalloproteinases by the corneal epithelium. Invest Ophthalmol Vis Sci 2006; 47: 3293-302.
- Dougherty JM, McCulley JP. Bacterial lipases and chronic blepharitis. Invest Ophthalmol Vis Sci 1986; 27: 486-91.
- Foulks G, Bron AJ. A clinical description of meibomian gland dysfunction. Ocul Surf 2003; 1: 107-26.