Tratamiento de la perforación corneal inmunológica mediante ciclosporina tópica al 2%
Dres. Ispa Callén C1, Lara Medina J1, Celis Sánchez J1, García Torre M1, López-Romero S1, López-Mondéjar E1, González del Valle F1
1 Servicio de Oftalmología. Hospital La Mancha Centro. Alcázar de San Juan (Ciudad Real).
Introducción
La artritis reumatoide es una enfermedad reumatológica que afecta alrededor del 1% de la población general, siendo más frecuente su aparición y diagnóstico en mujeres de edad media.
El diagnóstico de esta enfermedad se realiza mediante el uso de unos criterios clínicos entre los que no se incluye ninguno oftalmológico (1). Sin embargo, la afectación ocular en esta enfermedad es relativamente frecuente, con un amplio abanico de cuadros, que se extienden desde el síndrome de sequedad ocular (cuadro más frecuente, presente hasta en el 10-25% de pacientes) hasta la perforación ocular (2).
Presentamos en este artículo el caso clínico de una paciente con una perforación ocular inmunológica en el contexto de una artritis reumatoide, cuyo tratamiento se realizó con ciclosporina tópica al 2%.
Caso clínico
Una paciente de 50 años acude al servicio de oftalmología por presentar en su ojo derecho lagrimeo, dolor ocular y disminución de agudeza visual de 24 horas de evolución. Como antecedente de interés destaca una artritis reumatoide severa acompañada de síndrome de sequedad ocular grave bilateral, en tratamiento con colirios combinados de antibiótico y corticoides, lubricantes oculares y suero autólogo. La paciente había presentado episodios previos de abscesos corneales bilaterales, con una perforación corneal en ese mismo ojo que fue tratada mediante transplante de membrana amniótica tras una mala respuesta al cianocrilato. También destaca que la paciente había sido intervenida de cataratas en ambos ojos y en el ojo derecho se había complicado la cirugía con una endoftalmitis.
En la exploración, la paciente presentaba una agudeza visual de cuenta dedos a 3 metros en el ojo derecho, mejorando hasta 1/8 con estenopeico y de 1/4 en el ojo izquierdo que mejoraba hasta 1/2 con estenopeico. Mediante la lámpara de hendidura se observaba la existencia de una infiltración corneal central con un adelgazamiento severo del espesor corneal, junto con abundantes secreciones purulentas en fondos de saco conjuntivales. Además, la paciente mostraba una atalamia grado III, con subluxación anterior de la lente intraocular, con un test de Seidel positivo en el área de adelgazamiento corneal (fig. 1). En la exploración del ojo izquierdo destacaba un adelgazamiento corneal central y paracentral, pero sin signos inflamatorios ni infecciosos.

Fig. 1. Atalamia con incarceración del iris en la perforación corneal.
El tratamiento inicial de la paciente fue la colocación de una lente de contacto terapéutica, cicloplejía, lubricantes oculares sin conservantes, colirio de vancomicina reforzada tópica y ceftacidima reforzada y retirada de los corticoides tópicos. A las dos horas, la paciente había recuperado el tamaño de la cámara anterior, sin atalamia, sin reducirse los signos inflamatorios del cuadro. A las 24 horas de seguimiento, se añadió al tratamiento tópico colirio de ciclosporina al 2% y corticoides intravenosos.
Al día siguiente, la paciente había mejorado notablemente, reduciéndose los síntomas de dolor ocular, así como incrementándose la agudeza visual hasta 1/4 espontáneamente. En la exploración, se había reducido el tamaño de la infiltración corneal, apreciándose una neovascularización del área corneal adelgazada y, tras la retirada de la lente de contacto, ya no había un test de Seidel positivo (fig. 2). A las 48 horas del inicio del tratamiento con ciclosporina tópica había desaparecido la totalidad de la necrosis estromal corneal, persistiendo la zona de adelgazamiento corneal, pero totalmente recubierta por epitelio y neovasos. Tras superar la fase aguda, a los pocos días, se completó el tratamiento mediante la realización de un transplante bicapa de membrana amniótica, controlándose el cuadro hasta la actualidad mediante lubricantes, ciclosporina tópica al 0,5% y suero autólogo (fig. 3).

Fig. 2. Mejoría del cuadro de atalamia y reducción del área de necrosis corneal.
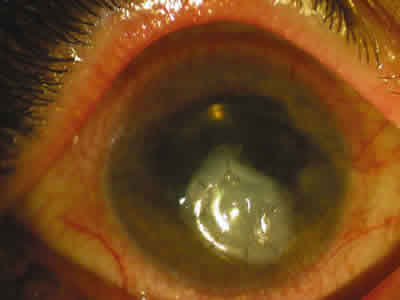
Fig. 3. Recubrimiento corneal con membrana amniótica.
Discusión
La afectación ocular más grave dentro de la artritis reumatoide es el cuadro mostrado de perforación ocular inmunológico (2). El tratamiento en esta situaciones busca como principales objetivos el conseguir el cierre corneal, evitar la sobreinfección y limitar la destrucción tisular. Para ello se utilizan, además de antibióticos tópicos y sistémicos, fármacos que promuevan la reepitelización corneal como son los lubricantes oculares y fármacos con alta actividad antiinflamatoria e inmunosupresora, sin incrementar el riesgo existente de infección ocular.
Los principales fármacos con actividad antiinflamatoria e inmunosupresora son los corticoides, los cuales presentan una alta potencia antiinflamatoria, pero con un incremento de la actividad colagenolítica, lo que puede suponer en este tipo de pacientes un mayor grado de deterioro tisular y un retraso en el curación corneal.
Estudios previos han señalado una potente actividad local inmunosupresora de la ciclosporina tópica sin incrementar la actividad colagenolítica, por lo que podría ser de mayor utilidad en este tipo de pacientes como fármaco antiinflamatorio (3). La ciclosporina A es un conocido agente inmunomodulador utilizado inicialmente para prevenir el rechazo tisular en transplantes de órganos (4), y actualmente su campo de acción se ha ampliado hacia el campo de las enfermedades autoinmunes (5).
La ciclosporina A es un metabolito del hongo Tolypocladium infatum. Su principal mecanismo de acción es la inhibición de la expresión de la interleukina 2 en las células CD4 tipo helper, previniendo la proliferación de las células T (5).
Múltiples estudios no controlados han demostrado previamente los beneficios del tratamiento tópico con ciclosporina tópica al 2% para las úlceras paracentrales y centrales de origen autoinmune asociadas a enfermedades reumatológicas. En un estudio, se utilizó ciclosporina tópica al 2% durante 4 veces al día en 5 pacientes con úlceras corneales paracentrales de origen reumatológico que no habían respondido a inmunosupresión sistémica. Tras la introducción del tratamiento, se detuvo rápidamente la queratolisis y se produjo una rápida reepitelización (6). En otro estudio, 5 pacientes con úlceras de origen inmunológico que no podían ser tratados mediante inmunosupresión sistémica por contraindicaciones o por efectos secundarios fueron tratados mediante ciclosporina tópica al 2% ó 0,5% durante 4 ó 6 veces al día respectivamente. Todos menos uno respondieron favorablemente, observándose una intensa neovascularización corneal en las primeras 48 horas del inicio del tratamiento (7).
El estudio histológico de estas úlceras corneales muestra acúmulos de macrófagos, linfocitos T y la expresión aberrante de HLA de clase II por los tejidos corneales y conjuntivales, lo que podría explicar esta buena respuesta tras la introducción de la ciclosporina A como tratamiento (8).
En nuestro caso, la abundante cantidad de secreciones purulentas no nos permitía descartar una infección en este paciente, por lo que inicialmente se pautaron antibioterapia sistémica y tópica antes de instaurar un tratamiento inmunosupresor que facilitase el crecimiento de gérmenes. Este riesgo de infección y el abundante grado de destrucción tisular fue el que nos impulsó a pautar ciclosporina tópica al 2% como agente antiinflamatorio e inmunosupresor, apoyados en los estudios anteriormente mencionados, donde se había demostrado la eficacia de este tratamiento en casos similares.
Conclusión
La ciclosporina tópica al 2% constituye una alternativa como fármaco inmunosupresor en las úlceras necrotizantes de etiología reumatológica, donde fundamentalmente existe un desorden a nivel inmunológico. Además, parece carecer de los inconvenientes fundamentales de los corticoides, como son el aumento de actividad colagenolítica y el incremento en la tasa de infecciones.
Bibliografía
- Arnett FC, Edworthy SM, et al. The american rheumatism association 1987 revised criteria for the classification of rheumatoid artritis. Artritis Rheum 1988; 31: 315-324.
- Harper SL, Foster CS. The ocular manifestations of rheumatoid disease. Int Ophthalmol Clin 1998; 38: 1-19.
- Belin MW, Bouchard CS, Phillips TM. Update on topical cyclosporin A: background, immunology, and pharmacology. Cornea 1990; 9: 184-195.
- Calne RY, White DJ, Thiru S, et al. Cyclosporin A in patients receiving renal allografts from cadaver donors. Lancet 1978; 2: 1323-1327.
- Nussenblatt RB, Palestine AG. Cyclosporin: immunology, pharmacology and therapeutic uses. Surv Ophthalmol 1986; 31: 159-169.
- Kervick GN, Pflugfelder SC , Haimovici R, et al. Paracentral rheumatoid corneal ulceration: clinical features and cyclosporin therapy. Ophthalmology 1992; 99: 80-88.
- Gottsch JD, Akpek EK. Topical cyclosporin stimulates neovascularization in resolving sterile rheumatoid central corneal ulcers. Trans Am Ophthalmol Soc 2000; 98: 81-87.
- Zierhut M, Thiel HJ, Weidle EG, et al. Topical treatment of severe corneal ulcers with cyclosporin A. Graefes Arch Clin Exp Ophthalmol 1989; 227: 30-35.