Sensibilidad al contraste en H-LASIK
Dres. Llovet Osuna F1, Benítez del Castillo Sánchez JM2, Arrevola Velasco L1, Martín Reyes C1, Ortega-Usobiaga J2, Cobo-Soriano R2
Clínica Baviera - Instituto Oftalmológico Europeo. Madrid.
1 Doctor en Medicina y Cirugía.
2 Licenciado en Medicina y Cirugía.
Resumen
Objetivo: Valorar los cambios aberrométricos, y en especial de la sensibilidad al contraste, que suceden en los ojos intervenidos de H-LASIK, además de la agudeza visual, y el cambio refractivo y queratométrico.
Método: Estudio prospectivo en el que se incluyeron 82 ojos (de 41 pacientes hipermétropes; 16 hombres y 25 mujeres), intervenidos mediante H-LASIK entre diciembre de 2003 y junio de 2004, con el objetivo de alcanzar la emetropía en ambos ojos. El tiempo mínimo de seguimiento fue de 6 meses.
Resultados: La edad media fue de 35 ± 5,01 años (rango 20-62 años). El defecto hipermetrópico (EE) refractivo medio pasó de +3,46 ± 1,19 D preoperatorias, a +0,77 ± 0,67 D postoperatorias. Tras la cirugía, el 43% de los ojos presentaron un equivalente esférico (EE) dentro del rango de ± 0,5 D, siendo este porcentaje del 66% para ± 1 D (predictibilidad). La AVSC (agudeza visual sin corrección) postoperatoria fue mayor o igual que la AVCC (agudeza visual con corrección) preoperatoria en el 53% de los casos (eficacia). Perdieron una o más líneas Snellen de AVCC el 2% de los ojos, lo que implica que el 98% mantuvieron al menos una AVCC postoperatoria similar a la AVCC preoperatoria (seguridad). El valor medio queratométrico preoperatorio fue de 43,98 ± 1,47 D, pasando a ser de 46,35 ± 2,04 D seis meses tras la cirugía.
Se produjo un aumento de las aberraciones de alto orden (HOA) de tipo coma y esfera. La sensibilidad al contraste no sufrió modificaciones (no empeoró), permaneciendo los valores para las cuatro frecuencias espaciales analizadas prácticamente inalterados en las revisiones del mes, 3 y 6 meses, hecho que nos ha llamado la atención.
No ocurrieron complicaciones durante el tallado lamelar corneal, ni durante el seguimiento postoperatorio a corto o largo plazo. El porcentaje de retratamientos (relasik mediante «lift-flap», o levantamiento del lentículo primario), fue del 10%.
Conclusión: El H-LASIK es una técnica quirúrgica que presenta, para el tratamiento de la hipermetropía baja y moderada, una aceptable eficacia y predictibilidad, siendo segura. Induce aberraciones de alto orden, pero, al contrario que en M-LASIK, no altera la sensibilidad al contraste.
Palabras clave: Hipermetropía, LASIK, sensibilidad al contraste.
Summary
Objective: To evaluate the optical aberrations and contrast sensitivity after H-LASIK, and also the visual acuity, refractive and keratometric changes.
Patients and methods: In this prospective study, 82 eyes of 41 patients (16 men and 25 women) were treated for hyperopia (H-LASIK) between December 2003 and June 2004, and followed for at least 6 months, in order to achieve emmetropy in both eyes.
Results: The mean patient age was 35 ± 5.01 years (range 20 to 62 years). Preoperatively, the mean spherical equivalent (SE) was +3.46 ± 1.19 D; postoperatively, it was +0.77 ± 0.67 D. Postoperatively, the mean SE was within ± 0.5 D in 43% of eyes, and within ± 1 D in 66% (predictability).
Postoperatively, uncorrected visual acuity (UCVA) was equal or better than preoperative best spectacle corrected visual acuity (BSCVA) in 53% of the eyes (efficacy). Regarding safety, a total of 98% of the eyes had no change in BSCVA at the end of the follow-up period (only 2% of the eyes lost one or more Snellen lines). Preoperatively, the mean keratometry was 43.98 ± 1.47 D; at six months, it was 46.35 ± 2.04 D.
Coma-like and spherical-like higher order aberrations (HOA) increased after H-LASIK. When compared with the preoperative values, contrast sensitivity remained stable (did not get worse), unexpectedly, one, three, and six months after the surgery.
No complications were observed intraoperatively or postoperatively. Ten percent of the eyes underwent an enhancement LASIK procedure (lifting the flap).
Conclusion: H-LASIK is a safe, effective and predictable modality to correct mild and moderate levels of hyperopia. H-LASIK resulted in an increase of aberrations, while the contrast sensitivity remained stable, in this study.
Key words: Hyperopia, LASIK, contrast sensitivity.
Introducción
La hipermetropía es un defecto de refracción consistente en que el enfoque de las imágenes en el ojo no acomodado se produce por detrás de la retina, formando en ésta un círculo de difusión, que ocasiona una imagen borrosa (1,2). Aunque es conocida desde la antigüedad, fue hace dos siglos cuando Donders (1858) y Helmholtz (1859) establecieron su definición actual.
Es el estado refractivo normal durante la edad pediátrica (3). Tiende a aumentar ligeramente durante la primera infancia, decrece durante la adolescencia, permanece estacionada en la edad media y puede volver a aumentar en la senectud, debido a los cambios del cristalino. Un estudio acerca de los errores refractivos en Estados Unidos (EEUU), Europa Occidental (EO) y Australia, realizados en la población de 40 años de edad, estima que la prevalencia de hipermetropía de 3 D o más es del 9,9% en EEUU, 11,6% en EO y 5,8% en Australia. Siendo la tasa de miopía (con más de >1D) de 25,4%, 26,6% y 16,4% respectivamente (4).
Los primeros pasos en el camino de la corrección quirúrgica de la hipermetropía fueron dados por Lans, en 1989, con animales de experimentación; consiguió incrementar el poder dióptrico corneal utilizando quemaduras radiales superficiales en córneas de conejos (5).
Técnicas incisionales como la queratotomía hexagonal (KH) (6), o técnicas lamelares como la queratofaquia, la epiqueratofaquia, y la queratomileusis, han disfrutado de éxito limitado, debido a la dificultad del procedimiento quirúrgico, la escasa predictibilidad y las complicaciones (7-11). Actualmente son técnicas en desuso.
La queratoplastia lamelar automática, precursora del LASIK hipermetrópico, utilizaba un microqueratomo para obtener una lamela profunda, debilitando el estroma corneal e induciendo una protusión corneal central (12,13). Sin embargo, está en desuso, ya que es un procedimiento indirecto y, como tal, de baja predictibilidad. Además del riesgo de ectasia incontrolada.
Actualmente existen dos vías principales de actuación en la cirugía de la hipermetropía: sobre la córnea (técnicas corneales) o intraocularmente (técnicas intraoculares) (14). Las técnicas refractivas corneales se pueden clasificar en: técnicas «sustractivas» que tratan de modificar la estructura corneal mediante la eliminación de tejido, consiguiendo modificar el poder refractivo del ojo en la búsqueda de la emetropia (PRK, LASIK, LASEK, EPILASIK) (15); y técnicas «no sustractivas», que buscan modificar el estado refractivo ocular sin eliminar tejido corneal (LTK, KC, DTK). A su vez, la cirugía refractiva hipermetrópica intraocular se fundamenta en la implantación de lentes fáquicas o pseudofáquicas (16).
El cambio de la curvatura corneal inducido por el efecto térmico es conocido desde hace tiempo. Se utilizó el cauterio (Gayet, 1879; Lans, 1898; Terrien, 1900), y posteriormente aplicadores eléctricos ultrafinos, menos agresivos que el cauterio (Parr y Stringer, 1969; Gasset, 1970). Más tarde se emplearon agujas intraestromales conectadas a energía eléctrica en la llamada Termoqueratoplastia Radial Intraestromal de Fyodorov (1981) y mediante ondas de radiofrecuencia (Rowsey, 1980) (17-19). Técnicas en las que se fundamentan la queratoplastia conductiva (KC), actualmente en boga, y la diatermoqueratoplastia (DTK) (20).
El empleo de los láseres como fuente generadora de calor para tratamiento sobre la córnea tuvo su origen al final de la década de los 70 y principios de los 80. Inicialmente se probaron distintos láseres, pero fueron los estudios realizados con el láser de Holmium:YAG realizados por Koch, Moreira, Seiler (láser Holimum: Yttrium-Aluminium-Garnet de contacto) y Durrie (láser Holmium:YAG de no contacto) los que ofrecieron mejores resultados; siendo este último el método de elección de aplicación de calor en la córnea mediante láser (21-25).
Diversos acontecimientos llevaron al descubrimiento del láser excímer como instrumento refractivo. En 1987 Theo Seiler lo aplicó por primera vez sobre un ojo completamente sano, «realizando cortes en T» para corregir su astigmatismo (26). Entre tanto, Munnerlyn desarrolló un algoritmo computarizado que relacionaba el diámetro de la ablación circular central de la córnea y su profundidad máxima, para obtener el cambio dióptrico requerido (27). McDonald (1998) aplicó con éxito dicha técnica en un ojo sano en Estados Unidos (28). Peter J McDonnell fue pionero en la ablación de la superficie corneal con láser excimer para la corrección de astigmatismo miópico simple y compuesto (29). También se han desarrollado tecnologías para corregir la hipermetropía e incluso la presbicia (30-35). Podemos afirmar que la queratectomía fotorrefractiva o PRK (photorefractive keratectomy) es una técnica que permite corregir defectos miópicos, astigmáticos o hipermetrópicos remodelando la córnea con el láser excímer. Fue aprobada por el FDA en 1995 para el tratamiento de la miopía y en 1998 para la hipermetropía.
La Queratomileusis subepitelial (LASEK) (Camellin, 1999) conserva el epitelio corneal, tras desprenderlo con una solución de alcohol, y lo repone tras realizar la ablación con láser excímer directamente sobre la membrana de Bowman (36). Es una modificación de la PRK; eficaz, al menos tanto como el LASIK, para el tratamiento de la miopía leve y moderada, evitando las complicaciones derivadas del tallado del lentículo (37-40). También ha sido descrita para el tratamiento de defectos hipermetrópicos (41).
La queratomileusis asistida con láser excímer (LASIK) está basada en los principios establecidos por el Dr. José Barraquer en 1964 (42); se realiza el tallado de un lentículo corneal, con microqueratomo, para posteriormente ablacionar lecho estromal con la intención de corregir el error refractivo. A lo largo de los años 80, Pallikaris y Buratto desarrollaron la técnica (43,44). El LASIK fue empleado inicialmente para alta miopía (45,46), si bien su uso se ha ido limitando a miopías bajas y medias (47). Del LASIK hipermetrópico también vamos conociendo resultados, indicaciones, limitaciones (48,33,49).
Una reciente opción para la corrección de grados elevados tanto de miopía, astigmatismo e hipermetropía son las lentes intraoculares fáquicas. La colocación de las lentes en cámara anterior [de «apoyo angular» o de fijación iridiana (50,51)] puede asociarse con una pérdida endotelial significativa (52). Motivo por el cual están en auge las lentes fáquicas de cámara posterior (ICL-STARR surgical lens, PRL) (53,54). Técnica que también resulta útil en aquellos pacientes con un grosor corneal insuficiente para el tratamiento con láser excímer.
La lensectomía refractiva, con implante de lente intraocular está indicada en personas de edad présbita y con ametropías elevadas, entre ellas la hipermetropía (55-57).
El LASIK se ha impuesto en la cirugía refractiva mundial como técnica de elección en el tratamiento quirúrgico de la mayoría de las ametropías miópicas, astigmáticas e hipermetrópicas (58,59). Los resultados refractivos, la eficacia, seguridad y predictibilidad se pueden calificar de excelentes (60,61). Sin embargo, hoy en día, hablamos de un nuevo concepto, la calidad de visión, que junto con los parámetros anteriormente citados conformarán la «satisfacción» de los pacientes (62,63). Además, disponemos de sistemas de evaluación de algunos de los factores que definen la función visual tras LASIK, como son los métodos de medida de la sensibilidad al contraste, y los aberrómetros (64-66).
El objeto de este estudio es valorar, además de la agudeza visual y el cambio refractivo y queratométrico, también los cambios aberrométricos y en especial de la sensibilidad al contraste en los ojos intervenidos de H-LASIK.
Material y métodos
Se presenta un estudio prospectivo de 82 ojos (de 41 pacientes; 16 hombres y 25 mujeres), todos ellos hipermétropes, intervenidos por un cirujano (FLLO), en las Clínicas Baviera de Valencia y Madrid, entre diciembre de 2003 y junio de 2004. Todos los casos fueron sometidos a H-LASIK, con el objetivo de alcanzar la emetropía en ambos ojos. El tiempo mínimo de evolución exigido para la inclusión en el estudio fue de 6 meses.
Se les realizó una exploración estándar de cirugía refractiva de la córnea. Cumplieron, en todos los casos, los criterios «al uso» para considerarlos aptos para ser intervenidos de H-LASIK (47,64). Le fueron explicados pormenorizadamente las cuestiones relacionadas con la intervención (alternativas, técnica, complicaciones, etc.) y se les solicitó su Consentimiento Informado.
Para el tallado lamelar de la córnea se usó el microqueratomo manual Moria LSK-ONE. Se efectuó siempre paquimetría US preoperatoria total, e intraoperatoria intraestromal. La ablación estromal refractiva se realizó, basándonos en la refracción ciclopléjica, mediante el láser excimer TECHNOLAS 217-Z, o el láser excimer MEL-80.
Para la exploración de la sensibilidad al contraste se utilizó el CSV 1000 (Vector Vision, Greenville, OH). Este aparato proporciona una luz fluorescente que retroilumina una pantalla traslúcida y una serie de fotocélulas monitorizan y calibran automáticamente el nivel de iluminación de la pantalla a 85 candelas/m 2 . La pantalla presenta rejillas sinusoidales verticales con cuatro frecuencias espaciales: 3, 6, 12 y 18 cpg (ciclos por grado). Cada frecuencia está presentada en una fila de la pantalla. Se selecciona con un mando a distancia de rayos infrarrojos la secuencia deseada entre 5 opciones: A, B, C, D o ninguna iluminada. En cada línea hay 17 círculos de 1,5 pulgadas de diámetro: el primer círculo de la línea presenta una muestra de alta SC y los 16 círculos restantes van en parejas, de modo que una de ellos contiene una rejilla sinusoidal y el otro está vacío. Los círculos que contienen la rejilla van disminuyendo el contraste conforme se desplazan hacia la derecha de la línea. El paciente se coloca a una distancia de 2,4 metros y observar el círculo de muestra. A continuación debe identificar en cuál de los dos círculos (en el de arriba o en el de abajo) se encuentra la rejilla sinusoidal. El nivel de contraste de la última respuesta correcta representa el umbral de contraste, que se marca en la curva de la prueba. Se repiten los mismos pasos con todas las filas (68).
El estudio del patrón aberrométrico se realizó con el aberrómetro, tipo Hartmann-Shack, Zywave de Baush & Lomb (Technolas GMBH Ophthalmologische Systeme, Max-Plank-Strasse, Munich). Los resultados los presenta en forma de refracción convencional mediante lo que se llama la refracción predicha por el foróptero (PPR). Esta consta de un componente esférico, otro cilíndrico y un eje. Calcula aberraciones hasta 5.º orden de Zernike, que incluye 18 aberraciones. Para obtener los datos se coloca al paciente frente al aberrómetro, fijando la cabeza para evitar movimientos durante el examen, apagando la luz del habitáculo para no distorsionar la obtención del frente de ondas. A continuación se toman tres muestras sin dilatación pupilar y tres bajo dilatación con gotas de fenilefrina al 10%, ya que esta dilatación no induce aberraciones. Se escoge de estas tres últimas mediciones la que tiene un equivalente esférico más aproximado al equivalente esférico subjetivo (69).
Resultados
La edad media fue de 35 ± 5,01 años (rango 20-62 años).
Resultados refractivos
El equivalente esférico (EE) medio preoperatorio fue de 3,46 ± 1,19 D; postoperatoriamente, el EE medio fue de 0,77 ± 0,67 D. En la tabla I se especifican los valores medios de la esfera, el cilindro y el equivalente esférico (con y sin cicloplejía) y los resultados refractivos al mes, tres y seis meses.
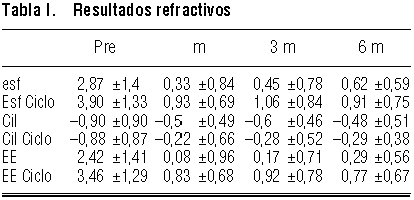
Tras la cirugía, el 43% de los ojos presentaron un equivalente esférico (EE) dentro del rango de ± 0,5 D, siendo este porcentaje del 66% para ± 1 D (predictibilidad).
Resultados visuales
El porcentaje de ojos cuya AVSC (agudeza visual sin corrección) postoperatoria es mayor o igual a la AVCC (agudeza visual con corrección) previa, fue del 53% (eficacia). Perdieron una o más líneas de mejor agudeza visual corregida el 2% de los ojos, lo que implica que el 98% de los ojos mantuvieron al menos una AVCC postoperatoria similar a la AVCC preoperatoria (seguridad).
Resultados queratométricos
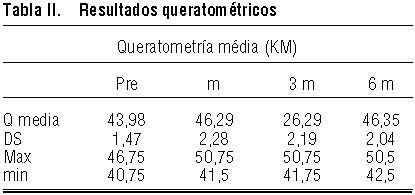
El valor medio queratométrico preoperatorio era de 43,98 ± 1,47 D. Seis meses tras la cirugía, era de 46,35 ± 2,04 D. El rango y la evolución del cambio queratométrico al mes y tres meses se presentan en la tabla II.
Resultados aberrométricos
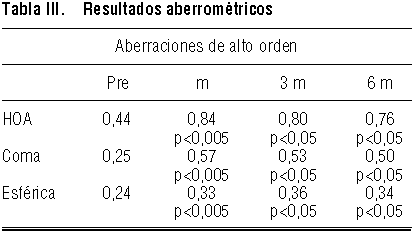
Fue notorio el aumento de las aberraciones de alto orden (HOA) (en la tabla III se muestran los valores en las HOA, coma y esfera).
Sensibilidad al contraste
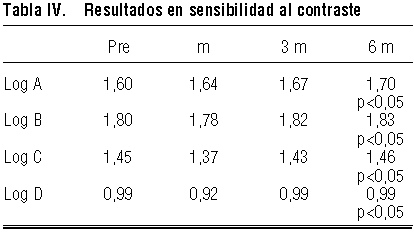
Sin embargo, nos ha llamado la atención, que no sólo no hemos encontrado un empeoramiento de la sensibilidad al contraste, sino que los valores permanecen prácticamente inalterados en las revisiones del mes, tres y seis meses (ver tabla IV), en las cuatro frecuencias espaciales analizadas.
Complicaciones
No se presentaron en el tallado lamelar. Tampoco cabe mencionar complicación alguna en el postoperatorio ni a corto ni a largo plazo (si excluimos los retratamientos).
El porcentaje de retratamientos (relasik mediante lift-flap, o levantamiento del lentículo primario) fue del 10%.
El análisis estadístico se ha efectuado con la t de Student y el Chi-test cuadrado; señalando como diferencias estadísticamente significativas los valores de p menores de 0,05.
Discusión
El H-LASIK para la corrección de la hipermetropía presenta una efectividad aceptable y, con mucho menor riesgo de opacidad corneal, regresión y otras complicaciones que los observados con otros procedimientos quirúrgicos; convirtiéndose así en la técnica de elección en la actualidad (70,71).
Diversos autores han utilizado H-LASIK en el tratamiento de la hipermetropía secundaria a hipercorrecciones tras queratotomía radial, con resultado satisfactorio (72-74).
Sin embargo, la corrección con LASIK de los defectos hipermetrópicos ha ido siempre a la zaga de los avances conseguidos en el tratamiento de los defectos miópicos. La mayor regresión refractiva, la menor predictibilidad, el grado de defecto tratable, y las aberraciones inducidas son algunos de los parámetros en los que encontramos diferencias significativas entre M-LASIK y H-LASIK (47,75). También la experiencia en la corrección de la hipermetropía con láser excímer es significativamente menor que en la miopía (el índice de artículos médicos sobre lasik miópico/hipermetrópico es de 85% contra 15%, respectivamente).
Actualmente los límites del H-LASIK están siendo revisados. Se acepta como límite dióptrico +5,00 dioptrías (D) (76-78), pero hay una gran variabilidad en los artículos publicados que lo extienden en el rango desde de +3,00 D a +6,00 D (79-83). Por otra parte, el límite superior de la queratometría postoperatoria varía de 48,00 D a 51,00 D, aunque algunos autores no refieren límite alguno en este parámetro, sino que valoran la magnitud del cambio queratométrico (33).
En este estudio apreciamos, al igual que Zadok (84), Jin (30) y otros estudios anteriores realizados por nosotros (33), que la eficacia y predictibilidad son significativamente menores, cuando se compara con el M-LASIK (75).
Sin embargo, no ocurre así con la seguridad, ya que es muy elevada en H-LASIK [conclusión similar obtuvimos en un estudio anterior (33)]; coincidiendo con lo referido por otros autores (30).
La inducción de aberraciones ópticas que provoca la técnica LASIK está claramente recogida en la literatura oftalmológica. Albarran-Diego (85) muestra en su estudio la evidencia de dicha inducción tras H-LASIK. Kohnen (86), en un estudio de 50 ojos miopes y otros tantos hipermétropes, encontró un incremento de las HOA en ambos grupos.
Las referencias que diversos autores (87-90) hacen a las variaciones en la sensibilidad al contraste tras M-LASIK son múltiples (87-90). Hemos encontrado un estudio realizado por Ueda (91), en 13 ojos intervenidos de H-LASIK, en el que menciona ausencia de deterioro en dicho factor visual en condiciones fotópicas, aunque sí lo encuentra en condiciones escotópicas (si bien lo relaciona con otros factores como el descentramiento, perfil de ablación o zona óptica).
En nuestro estudio, además, presentamos como hecho diferencial respecto a M-LASIK, la nula modificación de la sensibilidad al contraste encontrada en los ojos objeto de nuestro estudio, en todas las frecuencias espaciales y en todas las revisiones protocolizadas.
Conclusión
El H-LASIK es una técnica quirúrgica, para el tratamiento de la hipermetropía baja y moderada, con una aceptable eficacia y predictibilidad, aunque segura. Induce aberraciones de alto orden, pero, al contrario que en M-LASIK, no altera la sensibilidad al contraste, en este estudio.
Bibliografía
- Abrams D. Duke-Elder's Practice of Refraction. IX Ed. London: Churcill Livingstone Eds. 1978; 37-43.
- Belmonte N. Hipermetropía. In: Belmonte (Ed). Sobre refracción ocular. Barcelona: Doyma 1998; 49-55.
- Repka MX. Refraction in infants and children. In Nelson, Calhoun, Harley Eds. Paediatric Ophthalmology. Philadelphia : Saunders 1991; 94-106.
- Kempen JH, Mitchell P, Lee KE, et al. Eye Diseases Prevalence Research Group. The prevalence of refractive errors among adults in the United States , Western Europe , and Australia . Arch Ophthalmol 2004; 122: 495-505.
- Lans U. Experimentelle Untersuchungen uber die Entstehung von Astimatismus durch nicht-perforirende Corneawunden. Albrecht Von Graefes Arch Klin Exp Ophthalmol 1898; 45: 117.
- Jensen R. Hexagonal keratotomy: clinical experience with 483 eyes. Int Ophthalmol Clin 2001; 31: 69-73.
- Harr D. Sparring over hexagonal keratotomy. Refract Corneal Surg 2001; 8: 266-267.
- Grandon SC, Sanders DR , Anello RD , et al. Clinical evaluation of hexagonal keratotomy for the treatment of primary hyperopia. J Cataract Refract Surg 1995; 21: 140-149.
- Arenas-Archila E, Sanchez-Thorin JC, Naranjo-Uribe JP, Hernandez-Lozano A. Myopic keratomileusis in situ: a preliminary report. J Cataract Refract Surg 1991; 17: 424-435.
- Bas AM, Nano HD Jr. In situ myopic keratomileusis: results in 30 eyes at 15 months. J Refract Corneal Surg 1991; 7: 223-231.
- American Academy of Ophtalmology. Keratophakia and keratomileusis:safety and effectiveness. Ophthalmic orocedures assessment. Ophthlamology 1992; 99: 1332-1341.
- Kezirian GM, Gremillion CM. Automated lamellar keratoplasty for the correction of hyperopia. J Cataract Refract Surg 1995; 21: 386-392.
- Lyle WA, Jin GJ. Hyperopic automated lamellar keratoplasty. Arch Ophthalmol 1998; 116: 425-428.
- Brahma A, McGhee CN. Surgical correction of refractive errors (Review). J Roy Soc Med 2000; 93: 118-123.
- McGhee CN, Anastas CN, Jenkins L, et al. The surgical and laser correction of hypermetropia. In: McGhee CN, Taylor HR, Trokel S, Gartry D, Eds. Excimer lasers in ophthalmology: principles and practice. London : Martin Dunitz, 1997; 273-294.
- Kohnen T. Advances in the surgical correction of hyperopia. J Cataract Refract Surg 1998; 24: 1-2.
- Fyodorov S. Corneal curvature change using energy of laser radiation. (822407). 1980. Russia . (Patent).
- Neumann AC, Fyodorov S, Sanders DR. Radial thermokeratoplasty for the correction of hyperopia. Refract Corneal Surg 1990; 6: 404-411.
- Charpentier DY, Nguyen-Khoa JL, Duplessix M, et at. Intrastromal thermokeratoplasty for correction of spherical hyperopia: a 1-year prospective study. J Fr Ophtalmol 1995; 18: 200-206.
- Rehany U, Landa E. Diode laser thermal keratoplasty to correct hyperopia. J Refract Surg 2004; 20: 53 -61.
- Seiler T. Ho:YAG laser thermokeratoplasty for hyperopia. Ophthalmol Clin North Am 1993; 5: 773-780.
- Koch DD, Kohnen T, McDonnell PJ, et al. Hyperopia correction by noncontact holmium:YAG laser thermal keratoplasty. United States phase Ila clinical study with a 1 year follow up. Ophthalmology 1996; 103: 1525-1536.
- Pare JM, Ren 0, Simon G. Noncontact laser photothermal keratoplasty I: biophysical principles and laser beam delivery system. Refract Corneal Surg 1994; 10: 511-518.
- Simon G, Ren Q, Parel JM. Noncontact laser photothermal keratoplasty II: refraction effects and treatment parameters in cadaver eyes. Refract Corneal Surg 1994; 10: 519-528.
- Vinciguerra P, Kohnen T, Azzolini M, et al. Radial and staggered treatment patterns to correct hyperopia using noncontact holmium:YAG laser thermal keratoplasty. J Cataract Refract Surg 1998; 24: 21-30.
- Seiler T, Bende T, Wollensak J, Trokel S. Excimer laser keratectomy for correction of astigmatism. Am J Ophthalmol 1988; 105: 117-125.
- Munnerlyn CR, Koons SJ, Marshall J. Photorefractive keratectomy: A technique for laser refractive surgery. J Cataract Refract Surg 1988; 14: 46 -52.
- McDonald MB, Frantz JM, Klyce SD. Central phototherapeutic keratectomy for myopia: the blind eye for study. Arch Ophthalmol 1990; 108: 799-808.
- McDonald MB, Liu J, Byrd RJ. Central photorefractive keratectomy for myopia: partially sighted and normally sighted eyes. Ophthalmology 1991; 98: 1327-1337.
- Jin GJ, Lyle WA, Merkley KH. Laser in situ keratomileusis for primary hyperopia. J Cataract Refract Surg 2005; 31: 776-784.
- Rashad KM. Laser in situ keratomileusis for the correction of hyperopia from C1.25 to C5.00 diopters with the Technolas Keracor 117C laser. J Refract Surg 2001; 17: 113-122.
- Arbelaez MC, Knorz MC. Laser in situ keratomileusis for hyperopia and hyperopic astigmatism. J Refract Surg 1999; 15 :406-414.
- Cobo-Soriano R, Llovet F, Gonzalez-Lopez F, et al. Factors that influence outcomes of hyperopic laser in situ keratomileusis. J Cataract Refract Surg 2002; 28: 1530-1538.
- Mantrya S, Shahb S. Surgical management of presbyopia. Contact Lens Anterior Eye 2004; 27: 171-175.
- Baikoff G. Surgical treatment of presbyopia: scleral, corneal, and lenticular [Refractive surgery] Curr Opin Ophtahalmol 2004; 15: 365-369.
- Azar DT, Ang RT, Lee JB et al. Laser subepithelial keratomileusis: electron microscopy and visual outcomes of flap photorefractive keratectomy. Curr Opin Ophthalmol 2001; 12: 323-328.
- Claringbold TV. Laser-assisted subepithelial keratectomy for the correction of myopia. J Cataract Refract Surg 2002; 28: 18-22.
- Shahinian L Jr. Laser Assisted Subepitelial Keratectomy for Low to High Myopia and Astigmatism. J Cataract Refract Surg 2002; 28: 1334-1341.
- Pirouzian A, Ngo S, Thornton J. LASEK versus PRK. Ophthalmology 2006; 113: 1883.
- Autrata R, Rehurek J. Laser-assisted subepithelial keratectomy and photorefractive keratectomy for the correction of hyperopia. Results of a 2-year follow-up. J Cataract Refract Surg 2003; 29: 2105-2114.
- Barraquer JI. Keratomileusis. Inter Surg 1967; 48: 103-117.
- Buratto L, Ferrari M, Genisi C. Keratomileusis for myopia with the excimer laser (Buratto technique): short-term results. Refract Corneal Surg 1993; 9: S130-S133.
- Pallikaris IG, Papatzanaki ME, Siganos DS, Tsilimbaris MK . A corneal flap technique for laser in situ keratomileusis. Human Studies. Arch Ophthalmol 1991; 109: 1699-1702.
- Güell JL, Muller A. Laser in situ keratomileusis (LASIK) for myopia from -7 to -18 diopters. J Refract Surg 1996; 12: 222-228.
- Menezo JL, Martinez-Costa R, Navea A, Roig V. Excimer laser photorefractive keratectomy in high myopia. J Cataract Refract Surg 1995; 21: 393-397.
- Coret A, Cavero L. Algoritmos de decisión en cirugía refractiva. Majadahonda (Madrid): Ergon; 2003.
- Morcillo M, Amorós S, Baviera J. Tratamiento de la hipermetropía de equivalente esférico mayor de +5 D con LASIK: resultados. Microcirugía Ocular 2000; 2.
- Philip D, Jaycock PD, David PS, O'Brart DP, Rajan MS, Marshal JL. 5-Year Follow-up of LASIK for Hyperopia. Ophthalmology 2005; 112: 191-199.
- Bartels MT, Santana NT , Budo C. Toric phakic intraocular lens for the correction of hyperopia and astigmatism. Cataract Refract Surg 2006; 32: 243-249.
- Muñoz G, Alió JL, Montes-Micó R. Artisan iris-claw phakic intraocular lens followed by laser in situ keratomileusis for high hyperopia. J Cataract Refract Surg 2005; 31: 308-317.
- Pérez-Santonja JJ, Iradier MT, Sanz-Iglesias L, Serrano JM. Endothelial changes in phakic eyes with anterior chamber intraocular lenses to correct high myopia. J Cataract Refract Surg 1996; 22: 1017-1022.
- Fechner PU, Haigis W, Wichmann W. Posterior chamber myopia lenses in phakic eyes. J Cataract Refract Surg 1996; 22: 178-182.
- Vlokova E, Horackova M, Hruba H. Implantation of the Starr Surgical intraocular posterior chamber lenses for phakic eyes in medium and higher levels of myopia and hyperopia. Cesk Slov Oftalmol 2003; 59: 6-13.
- Lyle WA, Jin GJ. Clear lens extraction to correct hyperopia. J Cataract Refract Surg 1997; 23: 1051-1056.
- Menezo JL, Cisneros A, Harto M. Extracapsular cataract extraction and implantation of a low power lens for high myopia. J Cataract Refract Surg 1988; 14: 409-412.
- Carreras Diaz H, Rodríguez Hernadez JV. Cirugía del cristalino transparente. Balance de resultados de 2001. Arch Soc Canar Oftal 2002; 13.
- Jaycock PD, O'Brart DP, Rajan MS, Marshall J. 5-year follow-up of LASIK for hyperopia. Ophthalmology 2005; 112: 191-199.
- Cobo-Soriano R, Beltran J, Baviera J. LASIK outcomes in patients with underlying systemic contraindications: a preliminary study. Ophthalmology 2006; 113: 1124.
- Eleftheriadis B, Prandi B, Diaz-Rato A. The effect of flap thickness on the visual and refractive outcome of myopic laser in situ keratomileusis. Eye 2005; 19: 1290-1296.
- Sun L, Liu G, Li J. Efficacy and safety of LASIK in 10,052 eyes of 5081 myopic Chinese patients. J Refract Surg 2005; 21: S633-S635.
- Saragoussi D, Saragoussi JJ. Lasik, PRK and quality of vision: a study of prognostic factors and a satisfaction survey]. J Fr Ophtalmol 2004; 27: 755-764.
- Millar AE, McCulley, Bowman RW. Patient satisfaction after LASIK for myopia. CLAO J 2001; 27: 84-88.
- Kohnen T, Buhren J, Cichocki M. Optical quality after refractive corneal surgery. Ophthalmologe 2006; 103: 184-191.
- Jimenez JR, Villa C, Anera RG. Binocular visual performance after LASIK. J Refract Surg 2006; 22: 679-688.
- Wang JJ, Sun YC, Lee YC. The relationship between anterior corneal aberrations and contrast sensitivity in conventional LASIK. Curr Eye Res 2006; 31: 563-568.
- Elíes D, Coret A, Cavero LL, et al. Protocolos de actuación en cirugía refractiva. Annals d'Oftalmología 2001; 9: 158-164.
- Vázquez M, Güell JL. Exploraciones especiales en la alta miopía: Sensibilidad al contraste en cirugía refractiva. In: Corrección quirúrgica de la alta miopía. Menezo JL, Güell JL. Barcelona. Espaxs 2001.
- Carvalho LA, Castro JC, Chamon W, Schor P, Carvalho LA. Entendiendo las aberraciones ópticas del ojo y los principios de su medición. In: «Wavefront analysis»: Aberrómetros y Topografía Corneal. Edición en español. Highlights of Ophthalmology International, Panamá 2003.
- Kanellopoulos AJ, Conway J, Pe L. H-LASIK for hyperopia with the WaveLight excimer laser. J Refract Surg 2006; 22: 43 -47.
- Zaldivar R, Oscherow S, Bains HS. Five techniques for improving outcomes of hyperopic LASIK. J Refract Surg 2005; 21: S628-S632.
- Oral D, Awwad ST, Seward MS, Bowman RW, McCulley JP, Cavanagh HD. Hyperopic laser in situ keratomileusis in eyes with previous radial keratotomy. J Cataratc Refract Surg 2005; 31; 1561-1568.
- Lipshitz I, Man O, Shemesh G, et al. Laser in situ keratomileusis to correct hyperopic shift after radial keratotomy. J Cataract Refract Surg 2001; 27: 273-276.
- Portellinha W, Nakano K, Oliveira M, Simonceli R. Laser in situ keratomileusis for overcorrection after radial keratotomy. J Refract Surg 2000; 16: S253-S256.
- Cobo-Soriano R, Calvo MA, Beltran J. Thin flan laser in situ keratomileusis: Análisis of contrast sensitivity, visual an refractive outcomes. J Catacract Refract Surg 2005; 31: 1357-1365.
- Zadok D, Maskeleris G, Montes M, et al. Hyperopic laser in situ keratomileusis with the Nidek EC-5000 excimer laser. Ophthalmology 2000; 107: 1132-1137.
- Knorz MC, Liermann A, Jendritza B, et al. LASIK for hyperopia and hyperopicastigmatism-results of a pilot study. Sem Ophthalmol 1998; 13: 83-87.
- Philip D, Jaycock PD, David PS, O'Brart DP, Rajan MS, Marshal JL. 5-Year Follow-up of LASIK for Hyperopia. Ophthalmology 2005; 112: 191-199.
- Zadok D, Raifkup F, Landau D, Frucht-Pery J. Long-term evaluation of hyperopic laser in situ keratomileusis. J Cataract Refract Surg 2003; 29: 2181-2188.
- El-Agha MS, Johnston EW, Bowman RW, et al. Photorefractive keratectomy versus laser in situ keratomileusis for the treatment of spherical hyperopia. Eye Contact Lens 2003; 29: 31-37.
- Salz JJ, Stevens CA, LADARVision Hyperopic Study Group. LASIK correction of spherical hyperopia, hyperopic astigmatism and mixed astigmatism with the LADARVision excimer laser system. Ophthalmology 2002; 109: 1647-1656.
- Esquenazi S. Five-year follow-up of laser in situ keratomileusis for hyperopia using the Technolas Keracor 117C excimer laser. J Refract Surg 2004; 20: 356-363.
- Ditzen K, Fielder J, Pieger S. Laser in situ keratomileusis for hyperopia and hyperopic astigmatism using the Meditec MEL70 spot scanner. J Refract Surg 2002; 18: 430-443.
- Zadok D, Raifkup F, Landau D, Frucht-Pery J. Long-term evaluation of hyperopic laser in situ keratomileusis. J Cataract Refract Surg 2003; 29: 2181-2188.
- Albarran-Diego C, Muñoz G, Montes-Micó R. Corneal aberration changes after hyperopic LASIK: a comparison between the VISX Star S2 and the Asclepion-Meditec MEL 70 G Scan excimer lasers. J Refract Surg 2006; 22: 34 -42.
- Kohnen T, Mahmoud K, Buhren J. Comparison of corneal higher-order aberrations induced by myopic and hyperopic LASIK. Ophthalmology 2005; 112: 1692.
- Nakamura K, et al. Effect of laser in situ keratomileusis correction on contrast visual acuity. J Cataract Refract Surg 2001; 27: 357-361.
- Mutyala S, et al. Contrast Sensitivity Evaluation after Laser in Situ Keratomileusis. Ophthalmology 2000; 107: 1864-1867.
- Quesnel NM, et al. Laser in situ keratomileusis for myopia and the contrast sensitivity function. J Cataract Refract Surg 2004; 30: 1209-1218.
- Brown SM, et al. Visual field changes after laser in situ keratomileusis. J Cataract Refract Surg 2005; 31: 687-693.
- Ueda T, Nawa Y, Masuda K. Relationship between corneal aberrations and contrast sensitivity after hyperopic laser in situ keratomileusis. Jpn J Ophthalmol 2006; 50: 147-152.