Resultados visuales de pacientes afectos de obstrucción de rama venosa de la retina y edema macular no isquémico tratados mediante vitrectomía asociada a disección de la adventicia
Dres. López Guajardo L1, Teus Guezala M1, Guzmán Blázquez J2, Silva Mato A3
Hospital Universitario «Príncipe de Asturias». Servicio de Oftalmología. Alcalá de Henares. Madrid.
1 Doctor en Medicina y Cirugía. Universidad de Alcalá.
2 Licenciado en Medicina y Cirugía.
3 Doctor en Ciencias Exactas. Dpto. Bioestadística. Universidad de Alcalá.
Introducción
La obstrucción de rama venosa de la retina representa el segundo grupo de enfermedades vasculares de la retina en frecuencia tras la retinopatía diabética y es una de las causas principales de pérdida visual en pacientes de mediana y avanzada edad (1). La prevalencia en población adulta australiana (>40 años) es del 1,6% (2).
Las dos complicaciones más frecuentes que provocan disminución de AV son el edema macular y la hemorragia vítrea secundaria a neovascularización.
El diagnóstico de edema macular se determina clínicamente por la presencia de engrosamiento retiniano en la biomicroscopía macular, pero atendiendo al estudio angiográfico podemos encontrar dos tipos (3):
1. Edema macular no isquémico (fig. 1): Presenta una red capilar perifoveal prácticamente intacta y fuga angiográfica a ese nivel en tiempos tardíos del angiograma. En este grupo de pacientes se produce una mejoría espontánea en un porcentaje entre el 30-35% según series.
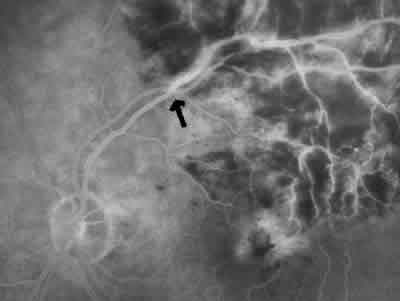
Fig. 1. Edema Macular no isquémico (AFG).
2. Edema macular isquémico (fig. 2): Estos pacientes presentan una ruptura de la red capilar perifoveal en la AFG con poca o prácticamente sin fuga angiográfica. En este grupo de pacientes se produce una superior tasa de resolución espontánea (91%) si lo comparamos con el edema no isquémico. Asimismo, la AV final media en este grupo se sitúa en los 2/3, lo que como posteriormente veremos desaconseja, en nuestra opinión, el tratamiento en este grupo de enfermos.
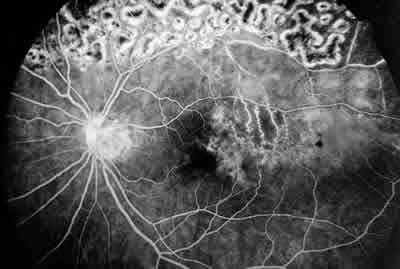
Fig. 2. Edema Macular isquémico (AFG).
El Branch Vein Occlusion Study (4) —BVOS— es un ensayo clínico multicéntrico, randomizado y controlado que estableció las pautas del tratamiento con láser de las complicaciones de la ORVR y que ha sido referencia desde entonces. El BVOS determinó que en el grupo de pacientes con edema macular secundario a ORVR, con AV inferior a 0,5, duración superior a 3 meses y red capilar perifoveal intacta en AFG deben recibir tratamiento con láser en forma de rejilla macular en el área afecta, pues el grupo tratado presentó una mejoría de AV de 2 líneas o más en un 65% frente a un 37% en el grupo control. Es interesante resaltar que se define un tiempo de espera pretratamiento de tres meses pues en ese periodo en algunos enfermos se produce lo que los autores denominan «resolución espontánea», es decir casos que se resuelven por mecanismos «propios» y que, tras ese periodo, alcanzan visiones que no les hace candidatos a tratamiento.
Una de las modalidades terapéuticas para el tratamiento de la ORVR más interesantes en la actualidad es la vitrectomía asociada o no a disección de la adventicia común.
Esta técnica fue descrita inicialmente en 1988 (5), pero la falta de una comunicación de resultados a largo plazo supuso que no tuviera gran repercusión hasta la aparición del artículo de Opremcak en 1999 (6) en que presenta un estudio piloto de 15 pacientes con edema macular secundario a ORVR y hemorragia prefoveal (que contraindica el tratamiento con láser) a los que se realiza una vitrectomía y disección de la adventicia común que comparten arteria y vena a nivel del cruce A/V responsable de la obstrucción (cruces con «arteria sobre vena»). En el estudio un 67% presenta una mejoría de AV media de cuatro líneas. Asimismo comunican una resolución de los casos con isquemia y la evidencia angiográfica de un restablecimiento del flujo venoso distal al cruce. Otra pequeña serie con evolución media de 6,5 años muestra una estabilidad a largo plazo de los resultados visuales de esta técnica (7).
Desde un punto de vista conceptual esta técnica aporta una solución «etiológica», pues ataca a la génesis del problema (el cruce arteriovenoso responsable), y además elimina la necesidad de destrucción de tejido retiniano central con láser, continuando la tendencia actual en el tratamiento del edema macular diabético. También aporta una solución para los casos con hemorragia prefoveal persistente que desaconseja la utilización del láser.
Así pues, diseñamos este estudio fundamentado en la hipótesis de que la vitrectomía asociada a disección de la adventicia en casos de ORVR con afectación macular no isquémica y agudeza visual mantenida durante los tres primeros meses inferior a 0,2 supone un beneficio clínico para el enfermo en cuanto a la mejoría en su agudeza visual.
Material y métodos
Estudio clínico prospectivo controlado no aleatorizado de pacientes consecutivos.
Se utilizaba un mismo observador enmascarado para la obtención de la AV.
Las cirugías fueron realizadas todas por el mismo cirujano (L.L.G.), siguiendo un protocolo operatorio que aparece más adelante.
El estudio no es aleatorizado porque no se consideró ético no ofrecer a todos los enfermos en los que estuviera indicada la posibilidad de cirugía, pues existían indicios clínicos del posible beneficio de esta técnica en este grupo de enfermos.
Comenzamos en mayo de 1999 seleccionando prospectivamente obstrucciones de rama venosa de la retina de segundo orden, con afectación macular, con más de tres meses de evolución. Esta última condición se establece para descartar aquellos casos en los que se produce una resolución espontánea de la obstrucción y por tanto del edema. Al seleccionar ORVR de segundo orden eliminábamos las obstrucciones de rama hemisféricas en las que la localización del cruce intrapapilar dificulta la disección, así como las obstrucciones de rama macular, en las que por su pequeño diámetro la disección de la adventicia es técnicamente imposible.
La AV corregida inicial y durante los tres primeros meses nunca debía superar 0,7 de LogMAR (0,2 Decimal). Este límite se establece pues los pacientes con AV de lejos de 0,2 (Decimal) o superior son capaces de leer (con su corrección de cerca adecuada) letra del tamaño Arial 12, que suele ser la utilizada en la mayoría de documentos, lo que permite al paciente una importante independencia funcional. La visión mínima se estableció en movimiento de manos a medio metro (+3,00 LogMAR), pues percepción de luz (con o sin proyección), no debe considerarse una medida de agudeza visual sino simplemente la detección de un estímulo. Por ello pacientes en este rango eran excluidos del estudio pues su función visual no es medible en términos de AV.
La fecha de inicio es en ocasiones difícil de establecer, por lo que dependemos del primer momento en que el paciente refiere síntomas. Algunos casos, cuando oftalmoscópicamente el cuadro ofrecía un aspecto más evolucionado que el deducible por la historia, fueron excluidos. También excluimos a aquellos pacientes con trombosis y presencia de neovascularización de polo anterior o posterior como consecuencia de ésta.
Por motivos obvios no incluimos aquellos pacientes que por una patología ocular intercurrente (retinopatía diabética —superior a retinopatía diabética no proliferativa leve según clasificación ETDRS—, glaucoma, etc.) pudieran alterar los resultados de AV.
La obstrucción de rama debía localizarse a partir de un cruce arteriovenoso en el que la arteria cruzara sobre la vena . El cruce de vena sobre arteria, además de ser poco frecuente origen de trombosis (1-2,4% según series) (8), presenta la dificultad de elevar el vaso venoso (con una pared más débil) al intentar disecar la adventicia común, por lo que no se incluyen.
A todos los pacientes previos a su inclusión realizaban una AFG, en la que determinábamos:
1. Naturaleza isquémica o no isquémica del edema macular, pues no se incluyeron en el protocolo pacientes con edema macular isquémico por su favorable historia natural.
2. Localización del cruce AV responsable para casos en que la abundante hemorragia hacía difícil la determinación oftalmoscópica.
3. Presencia de neovascularización retiniana o papilar, que también supondría su exclusión del estudio para recibir tratamiento con laser (fotocoagulación sectorial) en el área afecta.
Tampoco se incluyeron pacientes con esclerosis del cristalino moderada/grave, salvo que se realizara cirugía previa a su inclusión, pues la misma facoemulsificación podría suponer una mejoría visual superior a la vitrectomía asociada a disección.
Grupo Control
Aquellos pacientes que cumpliendo los criterios de selección, rechazaban la intervención quirúrgica, pero a los que se podía realizar AFG para determinar perfusión macular pasaban a formar parte del grupo control. Así, también se ofrecía una opción terapéutica probada con estudios controlados como es la fotocoagulación macular en rejilla del área afecta (ver Introducción) como alternativa a la intervención quirúrgica, que podía realizarse a partir del año, pues no está demostrado que el tratamiento con láser precoz favorezca el pronóstico. El cronograma de pruebas (AV, AFG) era similar al grupo tratado excepción hecha de la cirugía.
La AV era tomada de forma enmascarada por el mismo personal de enfermería en todas las visitas, mediante optotipos con escala LogMAR ( logarithm of the minimun angle of resolution ). Estos optotipos presentan varias ventajas. Primero las letras utilizadas en una misma línea tienen todas aproximadamente la misma detectabilidad (en anteriores optotipos algunas eran más difíciles de leer que otras). En segundo lugar cada línea tiene el mismo número de letras, y la separación entre letras es proporcional al tamaño de ellas. Ello permite una mayor precisión en la cuantificación de la AV, al interpolar entre los valores de la AV LogMAR la fracción del número de letras leídas en una línea (así si un paciente lee todas las letras de la línea 0,4, pero sólo tres de las cinco letras de la línea 0,3 su visión sería 0,34, pues el paciente lee 3/5 de la distancia entre 0,4 y 0,3, 3/5=0,6). En la escala decimal, la línea de 0,1 presenta una o dos letras, y en agudezas próximas a 1 mayor número de letras por línea, con lo cual esta precisión no es uniforme a lo largo de la escala. Lo que se suele realizar en estos casos es redondear anotando la última línea que se pudo leer completa o la mayoría de las letras. Este hecho reduce la precisión de la medición.
Además, el incremento de agudeza visual entre línea y línea es lineal (0,1) en la escala LogMAR, mientras que en la escala Snellen o Decimal el incremento es geométrico con un factor de 1,2589. Así, para obtener la media de visión correcta de un grupo de pacientes con estas dos últimas escalas, debemos obtener la media geométrica, que no corresponde con la aritmética (9).
La cirugía constaba de vitrectomía vía pars plana, extracción de la hialoides posterior y disección de la adventicia mediante esclerotomo modificado (doblando la punta con la ayuda de un portaagujas hasta formar un ángulo de aproximadamente 45° con el eje del instrumento- no utilizamos en ningún caso tijeras, pues han sido responsables de rotura de pared en venas retinianas) (10).
Análisis Estadístico
El análisis estadístico se realizó utilizando pruebas paramétricas, pues la prueba de Kolmogorov-Smirnov así lo permitía. En cualquier caso, y al tratarse de grupos inferiores a 30 individuos, se realizó una comprobación bajo condiciones no paramétricas.
Resultados
Demografía grupo tratado/grupo control
Grupo intervenido
El grupo intervenido lo componían 19 enfermos, con una edad media de 63,58 años (49-74), 9 mujeres y 10 varones, 5 DMNID en tratamiento con ADO, 6 HTA con tratamiento farmacológico y 2 pseudofáquicos.
Grupo control
El grupo control estaba formado por 8 enfermos, con una edad media 68 (60-79), 5 mujeres 3 varones, 2 DMNID en tratamiento con ADO y 3 HTA en tratamiento farmacológico.
No presentaban diferencias significativas en los factores relevantes para el estudio que impidieran su comparación.
Agudeza visual
Análisis de la varianza
Tras comprobar la asunción de distribución normal mediante prueba de Kolmogorov-Smirnov en el grupo tratado, el análisis de la evolución de la AV durante tres situaciones: preoperatorio y postoperatorio a los 90 y 365 días supone una serie de comparaciones que quedan reflejadas adecuadamente mediante un análisis de la varianza de 2 vías o análisis de medidas repetidas. En él, obtenemos una alta significación (p=0,001) indicativo de que los valores preoperatorios y tras la cirugía no son iguales.
Las comparaciones de medias posteriores (Bonferroni) evidenciaron que las diferencias son principalmente entre el periodo previo a la cirugía y las dos posteriores a la operación.
La utilización de pruebas no paramétricas (Friedman) obtenía asimismo una alta significación (p=0,002)
El análisis de medidas repetidas para el grupo control no presentó diferencias estadísticamente significativas tanto desde el punto de vista paramétrico como no paramétrico.
Estos resultados quedan resumidos en gráfica 1, donde se describe en formato «barras de error» la evolución de los resultados de agudeza visual del grupo tratado y control a lo largo del tiempo.
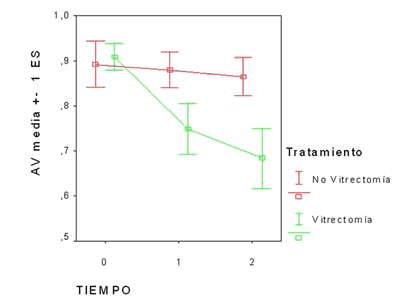
Gráfica 1. (Barras de error): Evolución de la AV en grupo tratado (verde) y grupo control (rojo) en los distintos momentos del seguimiento:
0=Pretratamiento.
1=90 días post tratamiento.
2=365 días post tratamiento.
Para estudiar más detalladamente la evolución, una vez sabemos que las diferencias son estadísticamente significativas en el grupo tratado según el ANOVA, realizamos una comparación entre la situación inicial y la alcanzada a los 90 y 365 días de forma independiente.
Evolución AV a los 90 días postratamiento
Se produjo una mejoría estadísticamente significativa (p=0,008) a los 90 días de la cirugía en la agudeza visual del grupo de pacientes tratados. Se utilizaron pruebas paramétricas (t de Student para muestras relacionadas) tras comprobar ajuste a una distribución normal mediante la prueba de Kolmogorov- Smirnov, pues el número de pacientes era inferior a 30 (gráfica 2).
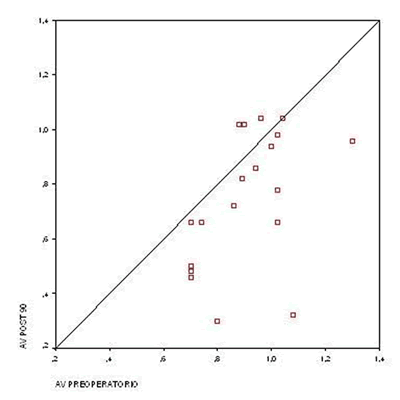
Gráfica 2. AV preoperatorio frente a AV postoperatorio 90 días de grupo tratado.
En cualquier caso también se utilizaron pruebas no paramétricas (prueba de los rangos con signo de Wilcoxon) con resultados también estadísticamente significativos (p=0,01).
La AV media (LogMAR) preoperatorio era de 0,92, alcanzando los 0,75 a los 90 días post cirugía, lo que supuso una mejoría media de 1,7 líneas.
Comparación con grupo control
En el grupo control no se produjeron diferencias estadísticamente significativas en cuanto a la media de AV al principio y final del periodo observacional (p=0,74) con test paramétricos (t de Student muestras relacionadas). Con no paramétricos se repetía resultados (Wilcoxon p= 0,478).
Ambos grupos presentaban una similitud importante en la situación inicial, con una AV media inicial en el grupo tratado de 0,92 y en el control de 0,89, que al ser comparadas mediante t de Student para muestras independientes no presentaban diferencias estadísticamente significativas con una p=0,771, para subpoblaciones que presentan varianzas iguales, pues la Prueba de Levene para igualdad de varianzas presenta una p=0,374.
Esta misma comparación realizada con U de Mann-Whitney ofrecía resultados equivalentes (p=0,897).
Al comparar la media de las diferencias entre la AV pretratamiento y la AV postratamiento en el grupo que recibió vitrectomía (m=0,17) frente a la diferencia de la AV tomada al inicio de la inclusión del enfermo y tras un periodo equivalente de tiempo en el grupo control (m=0,0125) se determinaba una diferencia estadísticamente significativa entre el grupo tratado y no tratado con p=0,032, para subpoblaciones donde no podemos demostrar igualdad de varianzas con p=0,05, según la prueba de Levene.
Evolución AV a los 365 días postratamiento
Al año de seguimiento el grupo tratado presentaba una AV media de 0,69, frente a los 0,92 preoperatoriamente, lo que suponía 2,3 líneas de mejoría (p=0,002). Igualmente, se utilizaron pruebas paramétricas (t de Student para muestras relacionadas) tras comprobar ajuste a una distribución normal mediante la prueba de Kolmogorov-Smirnov, pues el número de pacientes era inferior a 30.
En cualquier caso también se utilizaron pruebas no paramétricas. (Prueba de los rangos con signo de Wilcoxon) con resultados también estadísticamente significativos (p=0,003).
Comparación con grupo control
En el grupo control no se produjeron diferencias estadísticamente significativas en cuanto a la media de AV al principio (0,89) y final del periodo observacional (0,86) (p= 0,624) con t Student para datos pareados. Estudiada esta comparación bajo condiciones no paramétricas se mantenía el resultado (Wilcoxon p=0,674).
Como ya hemos visto en el apartado de la comparación tras transcurrir 3 meses desde la fecha de cirugía, ambos grupos presentaban una similitud importante en la situación inicial, con una AV media inicial en el grupo tratado de 0,92 y en el control de 0,89, que al ser comparadas mediante t de Student para muestras independientes presentaba una p=0,702, para subpoblaciones que presentan varianzas iguales, pues la Prueba de Levene para igualdad de varianzas presenta una p=0,560. La U de Mann-Whitney coincide en cuanto a la significación estadística, pues presenta un valor de p=0,894.
Al comparar la media de las diferencias entre la AV pretratamiento y la AV postratamiento al año en el grupo que recibió vitrectomía (m=0,232) frente a la diferencia de la AV tomada al inicio de la inclusión del enfermo y tras un periodo equivalente de tiempo en el grupo control (m=0,028) se determinaba una diferencia estadísticamente significativa entre el grupo tratado y no tratado con p=0,034, para subpoblaciones donde no podemos rechazar la hipótesis nula de igualdad de varianzas con p=0,291, según la prueba de Levene para igualdad de varianzas.
En este caso la estadística no paramétrica también presentaba resultados equivalentes, con una p=0,016 obtenida de la U de Mann-Whitney.
Resultados quirúrgicos
Al comparar las complicaciones surgidas durante nuestras cirugías con las referidas por otras series en que se realiza este mismo tipo de intervención (11-14), no encontramos diferencias en cuanto a la tasa y naturaleza de las mismas. En nuestra serie, 7 de los 17 pacientes fáquicos han precisado cirugía de cataratas posterior. No se realizó cirugía de cataratas simultánea a la vitrectomía, ni durante el primer año, para no alterar los resultados visuales postoperatorios.
Discusión
Como ya reflejábamos en los resultados, se produjo una mejoría estadísticamente significativa a los 90 días de la cirugía en la agudeza visual del grupo de pacientes. La AV media (LOGMAR) preoperatorio era de 0,92, alcanzando los 0,75 a los 90 días, lo que supuso un incremento medio de 1,7 líneas. Al año de seguimiento el grupo tratado presentaba una AV media de 0,69, frente a los 0,92 preoperatoriamente, lo que suponía 2,3 líneas de mejoría.
Esta progresión en la mejoría media (1,7 líneas —90 días— a 2,3 líneas —año—) también queda reflejada en otras series donde se estudia la evolución de los resultados en el tiempo (11).
Comparación con otras series publicadas
En los últimos años han aparecido múltiples estudios (algunos incluyen grupo control) que aunque no son exactamente homogéneos en cuanto a agudeza visual máxima de inclusión, momento de cirugía, inclusión de maculopatía isquémica, utilización de técnicas complementarias, etc., si nos permiten obtener una idea aproximada de como se encuentra la situación en la actualidad. Incluimos sólo aquellos grupos con número de pacientes superior a 10 en la tabla I (11-15).
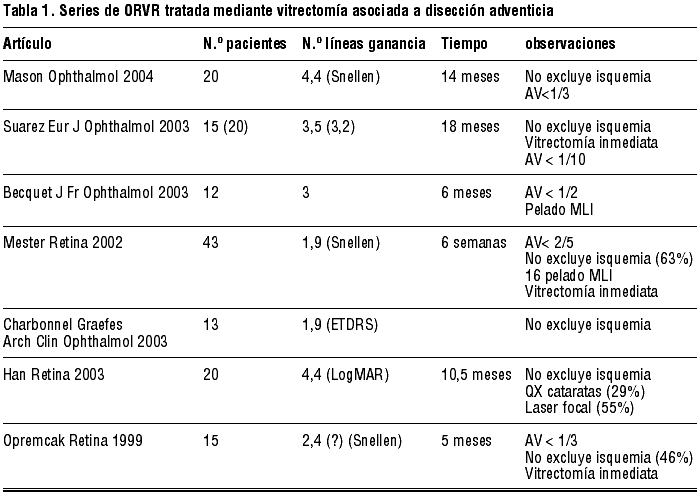
Es interesante comentar una serie de matices entre estos estudios y nuestra serie:
1. Un importante número de series operan a los pacientes de forma precoz, en el momento de su inclusión, lo que en nuestra opinión no debería realizarse, pues:
a) Elimina la posibilidad de recuperación espontánea ya apuntada en el Branch Vein Occlusion Study, y que podría ser causa de mejoría de algunos enfermos sin necesidad de cirugía.
b) Impide en ocasiones la suficiente desaparición de hemorragias que permite determinar la morfología del cruce responsable y, lo que nos parece más importante la presencia de isquemia macular (ver más adelante).
2. La inclusión de pacientes con isquemia macular, en los que según Finkelstein (ver Introducción) se produce mejoría espontánea en un 90% alcanzando una AV media de 2/3, supone la inclusión de un subgrupo de pacientes cuya evolución es buena, y que probablemente contribuyan a elevar la mejoría de la AV media postoperatoria.
3. La utilización de técnicas «complementarias».
a) Cirugía de catarata: La serie de Han operaba un 29% de los casos. No podemos delimitar la contribución de la facoexéresis a su mejoría visual.
b) Laser macular focal: Han lo aplicaba en un 55% de los casos, lo que introducía un nuevo factor de confusión.
c) Pelado de la Membrana Limitante Interna (MLI) Utilizado por Mester en un 37% de los casos y por Becquet en el 100% de su serie.
d) Hemodilución: 100% de los casos de la serie de Mester.
4. No todas las series utilizan una AV máxima de inclusión similar, oscilando desde 0,5 en el caso de Becquet hasta 0,1 en el caso de Suarez.
La diferencia entre nuestra mejoría de AV media (2,3 líneas) y las de otras series podría explicarse en parte a partir de estas diferencias de inclusión y metodología. Así:
a) Nosotros no incluíamos a los pacientes que presentaban isquemia macular, pues creemos que no son candidatos por su historia natural. Ello podría suponer la eliminación de pacientes que probablemente contribuyeran a mejorar la media.
b) Nuestra espera de 3 meses antes de indicar la cirugía elimina a pacientes que mejoran espontáneamente. Estos enfermos al ser operados probablemente también presenten una buena respuesta, pues sus mecanismos reparadores naturales es probable que no sean desfavorecidos por la cirugía.
c) No utilizamos ninguna otra técnica complementaria. En nuestra serie algunos enfermos comenzaron a presentar una disminución gradual de su AV, que achacamos al desarrollo de esclerosis nuclear. Tras la cirugía mejoraban, lo que nos indica que probablemente esta era la causa. Todos ellos fueron operados a partir del año de evolución. Si se incluyeran en la serie, es probable que supusieran una mejoría en los resultados.
Conclusiones
1. La agudeza visual media mejora de forma estadísticamente significativa a los 90 y 365 días en el grupo de pacientes con obstrucción de rama venosa de la retina y afectación macular, no isquemia macular angiográfica y agudeza visual inferior a 0,2 (0,7 LogMAR) tratados mediante vitrectomía asociada a disección de la adventicia.
2. La vitrectomía asociada a disección de la adventicia en casos de obstrucción de rama venosa de la retina ha demostrado ser una técnica segura y reproducible en nuestro grupo, no apareciendo un porcentaje de complicaciones superior al de otras series publicadas.
Bibliografía
- Orth DH, Patz A . Retinal branch vein occlusion . Surv Ophthalmol 1978; 22: 357-376.
- Mitchell P, Smith W, Chang A . Prevalence and associations of retinal vein occlusions in Australia . The Blue Mountains Eye Study. Arch Ophthalmol 1996; 114: 1243-1247.
- Finkelstein D . Ischemic macular edema. Recognition and favourable natural history in branch vein occlusion . Arch Ophthalmol 1992; 110: 1427-1434.
- Branch Vein Occlusion Study Group. Argon laser photocoagulation for macular edema in branch vein occlusion . Am J Ophthalmol 1984; 98: 271-282.
- Osterloth MD, Charles S . Surgical decompression of branch retinal vein occlusions . Arch Ophthalmol 1988; 106: 1469-1471.
- EM Opremcak, RA Bruce . Surgical decompression of branch retinal vein occlusion via arteriovenous crossing sheathotomy. Retina 1999; 19: 1-5.
- Gaurav K Shah, Sanjjay Sharma, Mitchell Fineman , et al. Arteriovenous adventitial sheathotomy for the treatment of macular edema associated with branch retinal vein occlusion. Am J Ophthalmol 2000; 129: 104-106.
- Jialiang Zhao, Srinvivas M Sastry, Robert D Sperduto et al. Arteriovenous crossing patterns in branch retinal vein occlusion. Ophthalmology 1993; 100: 423-428.
- Holladay JT . Proper method for calculating average visual acuity . J Refract Surg 1997; 13: 388-91.
- Tang WH, Han DP. A study of surgical approaches to retinal vascular occlusions . Arch Ophthalmol 2000; 118: 138-143.
- Figueroa MS, Torres R, Alvarez MT . Comparative study of vitrectomy with and without vein decompression for branch retinal vein occlusion: a pilot study . Eur J Ophthalmol 2004; 14: 40-7.
- Mester U, Dillinger P . Vitrectomy with arteriovenous decompression and internal limiting membrane dissection in branch vein occlusion . Retina 2002; 22: 740-746.
- Dieguez Millan JM, Suñer Cápo M, Olea Vallejo JL . Rotura intraoperatoria de vena en disección de cruce arteriovenoso . Arch Soc Esp Oftalmol 2002; 77: 575-578.
- Mason J, Feist R, White M, Swanner J, McGwuin G , et al. Sheathotomy to decompress branch retinal vein occlusion: a matched control study . Ophthalmology 2004; 111: 540-545.
- Charbonnel J, Glacet-Bernard A, Korobelnik JF, Nyouma-Moune E, Pournaras CJ,Colin J, Coscas G, Soubrane G . Management of branch retinal vein occlusion with vitrectomy and arteriovenous adventitial sheathotomy, the possible role of surgical posterior vitreous detachment. Graefes Arch Clin Exp Ophthalmol 2003.