Glaucoma pigmentario y cataratas
Dra. Méndez Hernández C1
1 Hospital Clínico San Carlos. Universidad Complutense de Madrid. Madrid.
Introducción
El glaucoma pigmentario (GP) es una de las formas más frecuentes de glaucoma secundario de ángulo abierto, caracterizado por la dispersión de pigmento iridiano en cámara anterior, y el aumento de presión intraocular (PIO) secundario a la obstrucción al flujo del humor acuoso a nivel de la malla trabecular. Esta dispersión de pigmento es la responsable de los hallazgos clínicos típicos del síndrome de dispersión pigmentaria (SDP) y del GP como son el huso de Krukenberg, la transiluminación en la media periferia del iris, hiperpigmentación de la malla trabecular y depósitos de pigmento en zónula, superficie anterior del iris y cristalino, aunque a veces, los típicos defectos de transiluminación iridiana pueden no ser evidentes en casos de iris muy oscuros (1,2) (figs. 1-6).
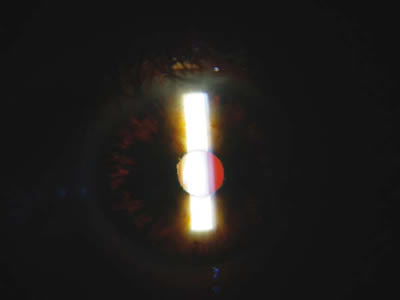
Fig. 1. Transiluminación iridiana.
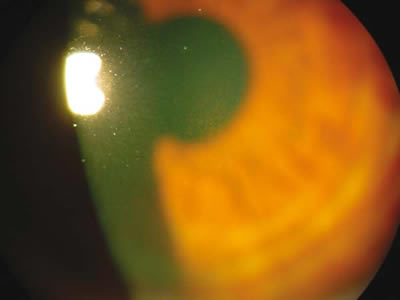
Fig. 2. Huso de Krukenberg.

Fig. 3. Trabeculum hiperpigmentado.
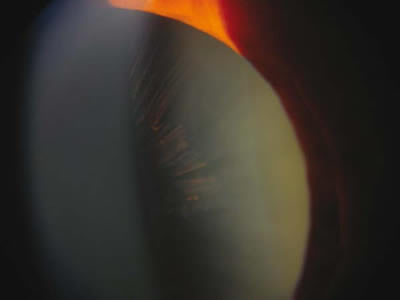
Fig. 4. Depósitos de pigmento en cristaloides anterior en un paciente con SDP.
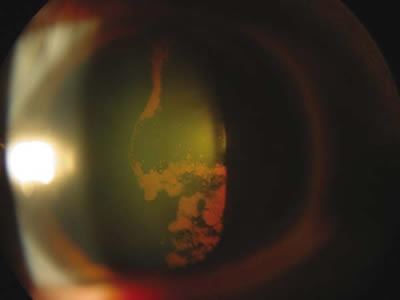
Fig. 5. Depósitos de pigmento en cristaloides posterior en un paciente con SDP.
Fig. 6. Depósitos de pigmento en cristaloides posterior en un paciente con SDP.
La dispersión de pigmento es debida al roce del epitelio pigmentario del iris, al adoptar este una morfología cóncava, con la zónula, cristalino y procesos ciliares (3-6). La concavidad iridiana está presente en la mayoría de los pacientes con SDP y GP. Potash estudia mediante BMU 16 ojos de 11 pacientes con SDP, demostrando concavidad iridiana en el 56% de los pacientes y contacto iridozonular en el 44,4% de pacientes con concavidad iridiana manifiesta (7). Breingan encuentra concavidad iridiana en todos los ojos de los pacientes estudiados (7 ojos de 7 pacientes diagnosticados de SDP) (8). Nosotros hemos encontrado concavidad iridiana manifiesta en 6 de 7 pacientes con diagnóstico de GP (6) (fig. 7).
Fig. 7. Modificación de la concavidad iridiana con acomodación. La concavidad del iris (a) se hace más evidente si el paciente mira a un punto situado a 30 cm (b).
Esta dispersión de pigmento es mayor en determinadas situaciones como el ejercicio y la acomodación (9-11) en las que tendría lugar un incremento de PIO como consecuencia de la mayor dispersión de pigmento.
El aumento de presión relativa de la cámara anterior respecto a la posterior, así como un mecanismo de bloqueo pupilar inverso inducen una concavidad del iris que facilita este contacto (7,8,12,13). El iris actuaría como una válvula que facilitaría el flujo del humor acuoso hacia la cámara anterior, dificultando su paso hacia cámara posterior. El aumento de presión relativa en la cámara anterior podría exagerar una concavidad iridiana prexistente o incluso ser la responsable de ésta (7,9). Además de la disposición cóncava del iris característica en estos pacientes se ha descrito la presencia de procesos iridianos prominentes, lo que favorecería un mayor contacto iridociliar.
La biomicroscopía ultrasónica (BMU), permite apreciar la mayor amplitud de la cámara anterior debido a la concavidad iridiana, los procesos iridianos prominentes, el contacto iridocristaliniano, iridozonular e iridociliar y la modificación de la concavidad con la acomodación, posición y ejercicio (7-16).
Síndrome de dispersión pigmentaria y GP
La prevalencia del SDP es del 2 al 4% de la población blanca con edades comprendidas entre los 20 y 40 años (3-5). Se ha encontrado una mayor incidencia en la raza negra y diferentes estudios orientan hacia una predisposición genética (17).
Los pacientes con SDP varones, miopes de más de 3 dioptrías o de raza negra tienen mayor riesgo de desarrollar GP. Se estima que aproximadamente el 20%-50% de los pacientes con SDP desarrollarán GP a los 10 años del diagnóstico (3,18). Gandolfi estudia 21 pacientes con SDP encontrando un aumento significativo de la PIO en los ojos no tratados frente a los que se realizó iridotomía YAG en 2 años de seguimiento (19), lo que orienta a que la iridotomía podría beneficiar a pacientes con SDP como prevención del desarrollo de GP.
Tratamiento
Las opciones terapéuticas para el control de PIO en el GP pasan por favorecer el drenaje uveoescleral mediante tratamiento tópico, iridotomía YAG, trabeculoplastia láser o intervención quirúrgica, dependiendo del estadío del glaucoma.
En cuanto al tratamiento tópico, parece que la prostaglandinas podrían desempeñar un papel importante en los estadíos iniciales de la enfermedad al favorecer el drenaje del humor acuoso por la vía uveoescleral (20).
La iridotomía YAG permite nivelar el gradiente de presiones existente entre la cámara anterior y la posterior restableciendo la morfología normal de la raíz iridiana disminuyendo la probabilidad de que se produzca contacto del epitelio pigmentario del iris con el cristalino, zónula y procesos ciliares y por tanto la dispersión de pigmento en cámara anterior (6,8,19). Con el restablecimiento de la morfología iridiana normal la dispersión de pigmento disminuiría y en estadíos iniciales de la enfermedad podría mejorar el control de PIO. Los pacientes más jóvenes parecen obtener una mejor respuesta al tratamiento probablemente por el menor tiempo de evolución de la enfermedad (6). Estaría especialmente indicada en pacientes jóvenes, en los que otros tratamientos eficaces para reducir la concavidad iridiana como los mióticos son mal tolerados por inducir espasmos de la acomodación y visión borrosa (21,22).
Su eficacia está condicionada por la irreversibilidad o no de los cambios sufridos en la malla trabecular. En estadíos más avanzados, el daño presente en la malla trabecular podría ser irreversible debido a la incapacidad de los macrófagos para eliminar todo el pigmento acumulado y a la necrosis de las células de la malla trabecular por la sobrecarga pigmentaria, estableciéndose una obstrucción al flujo del humor acuoso de forma permanente (1,23-25). En estos casos estarían indicados otro tipo de tratamientos como la trabeculoplastia láser o la cirugía. La iridotomía YAG aunque redujera la liberación de pigmento del iris no sería efectiva en el control de PIO si el daño de la malla trabecular es irreversible.
Los mejores resultados con trabeculoplastia láser se obtienen en pacientes jóvenes con menor tiempo de evolución aunque el control de la PIO a largo plazo es peor que en el glaucoma crónico simple. Es conveniente reducir la energía utilizada a la mitad y usar apraclonidina antes y después del tratamiento.
En estadíos más avanzados, la intervención quirúrgica es el tratamiento de elección. De la misma manera que la iridotomía YAG, la iridectomía que se realiza durante la trabeculectomía favorecería la remisión de la concavidad iridiana y con ello la causa del aumento de PIO, la dispersión de pigmento. Sin embargo, en otro tipo de intervenciones en las que no se realice iridectomía, como la esclerectomía no perforante podría persistir la dispersión de pigmento y el daño trabecular ya que no se modifica la morfología iridiana, que parece ser la responsable en gran medida del desarrollo de este cuadro.
GP secundario a cirugía de cataratas
El GP y/o SDP, secundarios al implante de lente intraocular (LIO) tras cirugía de cataratas puede producirse por una excesiva manipulación durante la intervención o en el postoperatorio. En este último caso, los mecanismos principales de dispersión de pigmento son el contacto entre el iris y la lente y la presencia de una cierta movilidad de la LIO en cámara posterior o pseudofacodonesis por inestabilidad de ésta. Igual que sucede en los implantes de lentes fáquicas en cámara posterior, la dispersión de pigmento es más frecuente en caso de implantarse la LIO en sulcus, por la menor distancia entre la LIO y el epitelio pigmentario del iris (26-32). Otros factores implicados son el tamaño inadecuado de la lente respecto a la distancia sulcus-sulcus y el material y grosor de ésta. Las lentes de silicona y las lentes de PMMA suturadas a sulcus, tienen más tendencia a dispersar pigmento en cámara anterior (33,34).
Algunos tipos de lentes por su diseño no deben implantarse en sulcus. Es el caso de la lente AcrySof. El borde cuadrado de la zona óptica y hápticos y su diseño hacen que la superficie de contacto LIO-iris sea mayor que con otros tipos de lentes (35-37). Su mayor diámetro relativo respecto al sulcus y la flexibilidad de los hápticos, facilitarían su movimiento en el eje anteroposterior, con una tendencia a la disposición cóncava de la LIO hacia atrás y los extremos de los hápticos orientados hacia delante con una mayor tendencia a la indentación del epitelio pigmentario del iris (33). La morfología de la lente, de bordes cuadrados tanto en la zona óptica como en los hápticos favorecería la dispersión de pigmento (36). Aunque el SPD o GP es más frecuente en casos en los que la lente Acrysof se implantó en sulcus (26-28,35-37), también se ha descrito en casos de implante en saco en los que ha habido un desplazamiento anterior de la lente por una rexis demasiado amplia o por descentramientos de la LIO que favorezcan que uno de los hápticos o parte de la zona óptica se sitúe en una posición más anterior. Un háptico situado por delante de la rexis puede producir una indentación sectorial del iris con dispersión de pigmento y atrofia del epitelio pigmentario de forma sectorial (fig. 8).
Fig. 8. Corte radial en el que se aprecia una lente de cámara posterior situada en sulcus. La flecha señala la posición del háptico (Dr. García Feijoó).
Por el mismo motivo la dispersión de pigmento sería también más frecuente tras realizar una técnica de piggyback (37).
En caso de rotura de cápsula posterior, el implante de una LIO que tenga una cierta inestabilidad en el sulcus tendrá más tendencia a dispersar pigmento a medida que se vaya modificando su posición. Una LIO monobloque o con un diámetro relativamente grande respecto a la distancia sulcus-sulcus, de morfología plana, con poca angulación en la unión entre la zona óptica y los hápticos, tendrán cierta movilidad anterior y más riesgo de descentramiento si se implantan en sulcus y darán con mayor probabilidad dispersión de pigmento al tener más tendencia al desplazamiento anterior de alguno de los hápticos (36,37).
La dispersión de pigmento secundaria a LIO se manifiesta clínicamente en los primeros meses tras la cirugía, generalmente en las primeras semanas del postoperatorio (29). El pigmento en cámara anterior asociado o no a un aumento de PIO no debe confundirse con una inflamación postoperatoria. La hiperpigmentación en el ángulo y las áreas de transiluminación iridiana local a veces con impronta de los hápticos responsables del roce con el epitelio pigmentario nos ayudarán en el diagnóstico diferencial
Mediante BMU se pueden analizar las relaciones anatómicas de las lentes intraoculares y localizar la situación intra/extrasacular de la zona óptica y hápticos (figs. 8 y 9).
Fig. 9. Zona óptica de los hápticos de una lente de cámara posterior situada en sulcus. La lente está en contacto con el iris (Dr. García Feijoó).
Si la dispersión de pigmento va acompañada de un incremento en la PIO, se puede mantener una actitud expectante controlando la PIO con tratamiento tópico (35). El explante de la lente se plantearía en aquellos casos con dispersión de pigmento mantenida durante meses en los que no fuera posible controlar la PIO con tratamiento tópico, ya que la dispersión de pigmento de forma crónica podría conducir a un daño irreversible de la malla trabecular y como sabemos, el daño presente en la malla trabecular en cuadros de larga evolución podría ser irreversible por la sobrecarga de pigmento.
Bibliografía
- Campbell DG. Pigmentary dispersion and glaucoma. A new theory. Arch Ophthalmol 1979; 97: 1667-1672.
- Chang S, Lim G. Secondary pigmentary glaucoma associated with piggyback intraocular lens implantation. J Cataract Refract Surg 2004; 30: 2219-2222.
- Farrar SM, Shields MB, Miller KN, Stoup CM. Risk factors for the development and severity of glaucoma in the pigment dispersion syndrome. Am J Ophthalmol 1989; 108: 223-229.
- Scheie HG, Cameron JD. Pigment dispersion syndrome: a clinical study. Br J Ophthalmol 1981; 65: 264-269.
- Richter CU, Richardson TM, Grant WM. Pigmentary dispersion syndrome and pygmentary glaucoma. A prospective study of the natural history. Arch Ophthalmol 1986; 104: 211-215.
- Mendez Hernandez C, Garcia Feijoo J, Cuiña Sardina R, Garcia Sanchez J. GP. Arch Soc Esp Oftalmol 2003; 78: 137-142.
- Potash SD, Tello C, Liebmann J, Richt R. Ultrasound biomicroscopy in pigment dispersion syndrome. Ophthalmology 1994; 101: 332-339.
- Breingan Peter J, Esaki Kohji, Ishikawa Hiroshi, Liebmann JM, Greenfield DS, Ritch R. Iridolenticular contact decreases following láser irdotomy for pigment dispersion syndrome. Arch Ophthalmol 1999; 117: 325-328.
- Jensen P K, Nissen O, Kessing SV. Exercise and reverse pupillary block in pigmentary glaucoma. Am J Ophthalmol 1995; 120: 110-112.
- Pavlin CJ, Harasiewicz K, Eng P, Foster FS. Posterior iris bowing in pigmentary dispersion syndrome caused by accomodation. Am J Ophthalmol 1994; 118: 114-116.
- Haynes WL, Johnson AT, Alward WL. Effects of jogging exercise on patients with the pigmentary dispersion syndrome and pigmentary glaucoma. Ophthalmolgy 1992; 99: 1096-1103.
- Liebmann J M, Tello C, Chew S J, Cohen H, Richt R. Prevention of blinking alters iris configuration in pigment dispersion syndrome and in normal eyes. Ophthalmolology 1995; 102: 446-455.
- Sokol J, Stegman Z, Liebmann JM, Ritch R. Location of the iris insertion in pigment dispersion syndrome. Ophthalmology 1996; 103: 289-293.
- Balidis MO, Bunce C, Sandy CJ, Wormald RPL, Miller MH. Iris configuration in accomodation in pigment dispersion syndrome. Eye 2002; 16: 694-700.
- Adam RS, Pavlin CJ, Ulanski LJ. Ultrasound biomicroscopic analysis of iris profile changes with accomodation in pigmentary glaucoma and relationship to age. Am J Ophthalmol 2004; 138(4): 652-654.
- Liebmann J M, Tello C, Chew S J, Cohen H, Richt R. Prevention of blinking alters iris configuration in pigment dispersion syndrome and in normal eyes. Ophthalmolology 1995; 102: 446-455.
- Andersen JS, Pralea AM, DelBono EA, Haines JL, Gorin MB, Schuman JS, et al. A gene responsible for the pigment dispersion syndrome maps to chromosome 7q35-q36. Arch Ophthalmol 1997; 115: 384-388.
- Lehto I, Vesti E. Diagnosis and management of pigmentary glaucoma. Curr Opin Ophthalmol 1998; 9: 61-64.
- Gandolfi SA, Vecchi M. Effect of a YAG láser iridotomy on intarocular pressure in pigment dispersion syndrome. Ophthalmology 1996; 103: 1693-1695.
- Mastropasqua L, Carpineto P, Ciancaglini M, Gallenga PE. A 12-month, randomized, double-masked study comparing Latanoprost with Timolol in Pigmentary Glaucoma. Ophthalmology 1999; 106: 550-555.
- Lehto I. Side effects of topical treatment in pigmentary glaucoma. Acta Ophthalmol, 1992; 70: 225-227.
- Weseley P, Liebmann J, Walsh JB, Richt R. Lattice degeneration of the retina and the pigment dispersion syndrome. Am J Ophthalmol 1992; 114: 539-543.
- Alvarado JA, Murphy CG. Outflow obstruction in pigmentary and primary open angle glaucoma. Arch Ophthalmol 1992, 110: 1769-1778.
- Murphy CG, Johnson M, Alvarado JA. Juxtacanalicular tissue in pigmentary and primary open angle glaucoma. Arch Ophthalmol, 1992; 110: 1779-1785.
- Jacobi PC, Dietlein TS, Krieglstein GK. Effect of trabecular aspiration on intraocular pressure in pigment dispersion syndrome and pigmentary glaucoma. Ophthalmology 2000; 107: 417-421.
- Woodhams JT, Lester JC. Pigmentary dispersion glaucoma secondary to posterior chamber intra-ocular lenses. Ann Ophtahlmol 1984; 16: 852-855.
- Samples JR, Van Buskirk EM. Pigmentary glaucoma associated with posterior chamber intraocular lenses. Am J Ophthalmol 1985; 100: 385-388.
- Masket S. Pseudophakic posterior iris chafing sindrome. J Cataract Refract Surg 1986; 12: 252-256.
- Pavlin CJ, Harasiewicz K, Foster FS. Ultrasound biomicroscopic analysis of haptic position in late-onset, recurrent hyphema alter posterior chamber lens implantation. J Cataract Refract Surg 1994; 20: 182-185.
- García Feijoo J, Alfaro IJ, Cuiña Sardiña R, Mendez Hernandez C, Del Castillo JM, Garcia Sanchez J. Ultrasound biomicroscopy examination of posterior chamber phakic intraocular lens position. Ophthalmology. 2003 Jan; 110(1): 163-172.
- García Feijoo J, Hernandez Matamoros JL, Mendez Hernandez C, Castillo Gomez A. Lazaro C, Martin T, Cuiña sardiña R, Garcia Sanchez J. Ultrasound biomicroscopy of silicone posterior chamber phakic intraocular lens for myopia. J Cataract Refract Surg. 2003 Oct; 29(10): 1932-1939.
- García Feijoo J, Hernández Matamoros JL, Castillo Gómez A, Méndez Hernández C, Martínez de la Casa J, Orte TM, García Sánchez J. Secondary glaucoma and severe endothelial damage after silicone phakic posterior chamber intraocular lens implantation. J Cataract Refract Surg. 2004 Aug; 30(8): 1786-1789.
- Watt RH. Pigment dispersion syndrome associated with silicone posterior chamber intraocular lenses. J Cataract Refract Surg 1988; 14: 431-433.
- Skorpik C, Menapace R, Gnad HD. Grasl M, Scheidel W. Evaluation of 50 silicone posterior chamber lens implantations. J Cataract Refract Surg 1987; 13: 640-643.
- Wintle R, Austin M. Pigment dispersion with elevated intraocular pressure after AcrySof intraocular lens implantation in the ciliary sulcus. J Cataract Refract Surg 2001; 27: 642-644.
- Micheli T, Cheung LM, Sharma S, Assaad NN, Guzowski M, Francis IC, Norman J, Coroneo MT. Acute haptic–induced pigmentary glaucoma with an AcrySof intraocular lens. J Cataract Refract Surg. 2002; 28: 1869-1872.
- Chang SH, Lim G. Secondary pigmentary glaucoma associated with piggyback intraocular lens implantation. J Cataract Refract Surg. 2004 Oct; 30 (10): 2219-2222.